Magnezijev fosfat (MG3 (PO4) 2)
- 1747
- 478
- Mr. Shane Larkin
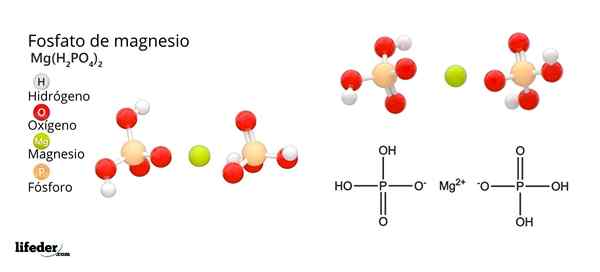
 Struktura in formula magnezijevega fosfata
Struktura in formula magnezijevega fosfata Kaj je magnezijev fosfat?
On Magnezijev fosfat To je izraz, ki se uporablja za nanašanje na družino anorganskih spojin, ki jih tvorijo magnezij, alkalna kovina in fosfat oksoanion. Najpreprostejši magnezijev fosfat ima mg kemijsko formulo3(Po4)2. Formula kaže, da za vsaka dva aniona PO43- Obstajajo tri mg katione2+ interakcijo s temi.
Prav tako lahko te spojine opišemo kot magnezijeve soli, pridobljene iz ortofosfahične kisline (H3Po4). Z drugimi besedami, magnezij je "zbran" med fosfatnimi anioni, ne glede na njegovo anorgansko ali organsko predstavitev (MGO, MG (ne3)2, MGCL2, MG (OH)2, itd.).
Zaradi teh razlogov lahko magnezijeve fosfate najdemo kot več mineralov. Nekatere od teh so: katteit -mg3(Po4)2 · 22h2O-, Struvita -(NH4) MGPO4· 6H2Ali, katerih mikrokristali so predstavljeni v vrhunski sliki -Holtedalita -mg2(Po4) (OH) - in bobierrit -mg3(Po4)2· 8h2Tudi-.
V primeru bobierrita je njegova kristalna struktura monoklinična, s kristalnimi agregati z masivnimi ventilatorji in rozetami. Vendar pa je za magnezijeve fosfate značilno, da ima bogato strukturno kemikalijo, kar pomeni, da njihovi ioni sprejmejo številne kristalne ureditve.
Oblike magnezijevega fosfata in nevtralnost njihovih obremenitev
Magnezijevi fosfati izhajajo iz zamenjave H protonov3Po4. Ko ortofosforna kislina izgubi proton, ostaja kot fosfatni dihidrogenski ion2Po4-.
Kako nevtralizirati negativno obremenitev, da povzroči magnezijevo sol? Da mg2+ Upoštevati dve pozitivni stroški, nato potrebujeta dva h2Po4-. Tako dobimo magnezijev diácido fosfat, mg (h2Po4)2.
Potem, ko kislina izgubi dva protona, ostane hidrogenovfosfatni ion, HPO42-. Zdaj kako nevtralizirati ta dva negativna naboja? Kot Mg2+ Za nevtralizacijo potrebujete samo dva negativna naboja, interakcijo z enim samim HPO ionom42-. Na ta način dobimo fosfat magnezijeve kisline: mGHPO4.
Vam lahko služi: magnezijev oksid: struktura, lastnosti, nomenklatura, uporabljaKončno, ko se izgubijo vsi protoni, ostaja fosfatni anion43-. To zahteva tri mg katione2+ in iz drugega fosfata, da se sestavi v kristalni trdni snovi. Matematična enačba 2 (-3) + 3 (+2) = 0 pomaga razumeti te stehiometrične deleže za magnezij in fosfat.
Kot rezultat teh interakcij nastaja tribazični magnezijev fosfat: Mg3(Po4)2. Zakaj je Tribasic? Ker je sposoben sprejeti tri H -jeve enakovredne+ Spet oblikovati h3Po4:
Po43-(AC) + 3H+(Ac) h3Po4(AC)
Magnezijevi fosfati z drugimi kationi
Nadomestilo negativnih pristojbin je mogoče doseči tudi s sodelovanjem drugih pozitivnih vrst.
Na primer za nevtralizacijo PO43-, K ioni+, Na+, Rb+, Nh4+, itd., Lahko tudi posredujejo in tvorijo sestavljeno (x) mgpo4. Če je x enak NH4+, Nastavljen je brezvodni mineral Struvita (NH4) MGPO4.
Daj. Zahvaljujoč temu je mogoče sintetizirati številne kristale magnezijevega fosfata (NA3RBMG7(Po4)6, Na primer).
Struktura

Vrhunska slika ponazarja interakcije med MG ioni2+ in po43- ki definira kristalno strukturo. Vendar je le podoba, ki bolj prikazuje tetraedrsko geometrijo fosfatov. Nato kristalna struktura pomeni fosfatno in magnezijevo sfero tetraedre.
V primeru Mg3(Po4)2 brezvodni, ioni sprejmejo romboedrsko strukturo, v kateri je Mg2+ je usklajen s šestimi atomi O.
Zgoraj je prikazano na spodnji sliki, z dimenzijo, da so modra krogla kobalt, samo spreminjajo jih za zelene sfere magnezija:
Vam lahko služi: ne -perozne zlitine: struktura, lastnosti, uporabe, primeri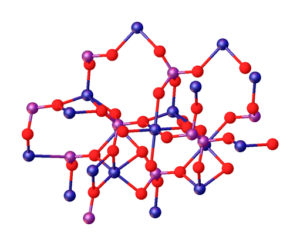
Ravno v središču konstrukcije je mogoče namestiti oktaedro, ki ga tvori šest rdečih kroglic okoli modrikaste krogle.
Tudi te kristalne strukture so sposobne sprejemati molekule vode, ki tvorijo magnezijev fosfat hidrate.
To je zato, ker tvorijo vodikove mostove s fosfatnimi ioni (HOH-O-PO33-). Poleg tega lahko vsak fosfatni ion sprejme do štiri vodikove mostove; to je štiri molekule vode.
Kot Mg3(Po4)2 Ima dva fosfata, lahko sprejme osem molekul vode (kar se dogaja z mineralom Bobierrite). Te molekule vode lahko tvorijo vodikove mostove z drugimi ali komunicirajo s pozitivnimi centri MG2+.
Lastnosti
Je bela trdna snov, ki tvori kristalne rombične plošče. Prav tako nima vonja in okusa.
V vodi je zelo netopna, tudi ko je vroče, zaradi svoje velike energije kristalne mreže; To je produkt močnih elektrostatičnih interakcij med Mg vsestranskimi ioni2+ in po43-.
To pomeni, da ko so ioni vsestranski in se njihovi ionski radijski sprejemniki ne razlikujejo veliko po velikosti, trdna snov kaže odpornost na njegovo raztapljanje.
Stopi na 1184 ° C, kar kaže tudi na močne elektrostatične interakcije. Te lastnosti se razlikujejo glede na to, koliko molekul absorbirane vode, in če je fosfat v nekaterih njegovih protoniranih oblikah (HPO42- ali h2Po4-).
Uporaba/aplikacije
Odvajalo
Uporablja se kot odvajalo za stanja zaprtja in želodčne kislosti. Vendar pa so njegovi škodljivi neželeni učinki - ki jih kažejo generacija driske in bruhanje - omejili njihovo uporabo. Poleg tega bo verjetno povzročil poškodbe prebavil.
Vam lahko služi: molekularni kisik: struktura, lastnosti, uporabePopravilo kosti
Trenutno se raziskuje uporaba magnezijevega fosfata pri popravilu kostnega tkiva, ki raziskuje uporabo MG (H2Po4)2 kot cement.
Ta oblika magnezijevega fosfata izpolnjuje zahteve za to: je biološko razgradljiva in histokompatibilna. Poleg tega se priporoča njegova uporaba pri regeneraciji kostnega tkiva za njegovo odpornost in hitro nastavitev.
Gradivo za ortopedijo
Uporaba amorfnega magnezijevega fosfata (AMP) se ocenjuje kot biološko razgradljiv in neeksotermični ortopedski cement. Za ustvarjanje tega cementa se zmeša amp v prahu s polivinilnim alkoholom, da se tvori kiti.
V živih bitjih
Glavna funkcija magnezijevega fosfata je, da služi kot Mg prispevek k živim bitjem. Ta element posega v številne encimske reakcije, kot sta katalizator ali posrednik, ki je bistvenega pomena za življenje.
Pomanjkanje MG pri ljudeh je povezano z naslednjimi učinki: znižanje ravni CA, srčno popuščanje, zadrževanje NA, znižane ravni K, aritmije, trajne kontrakcije mišic, bruhanje, slabost, nizke krožne ravni paratiroidnih hormona in želodca in menstrualnih krčev, med ostalimi.
Reference
- Objava mineralnih podatkov. (2001–2005). BOBIERRITE. Okrevano iz HanbookMineralogy.org
- Sahar Mousa. (2010). Študija o sintezi magnezijevih fosfatnih materialov. Bilten za raziskovanje fosforja. 24, str 16-21.
- Wikipedija. (2018). Magnezijev fosfat Tribasic. Pridobljeno iz.Wikipedija.org
- Pubchem. (2018). Magnezijev fosfat brezvoden. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Barbie, e., Lin, b., Goel, v.K. In Bhaduri, s. (2016) Vrednotenje neektermičnega ortopedskega cementa na osnovi amorfnega magnezijevega fosfata (AMP). Biomedicinska preproga. Zvezek 11 (5): 055010.
- Yu in., Yu, pogl. In dai, h. (2016). Priprava utripajočega magnezijevega kostnih cementa. Regenerativni biomateriali. Zvezek 4 (1): 231

