Diferencialni elektron

- 1044
- 17
- Adrian Legros
On diferencialni elektron o Diferensator je zadnji elektron, nameščen v zaporedju elektronske konfiguracije atoma. Kako ti je ime? Če želite odgovoriti na to vprašanje, je treba poznati osnovno strukturo atoma: njegovo jedro, praznino in elektrone.
Jedro je gost in kompakten agregat pozitivnih delcev, imenovanih protoni, in nevtralni delci, imenovani nevtroni. Protoni definirajo atomsko številko z in skupaj z nevtroni sestavljajo atomsko maso. Vendar atom ne more imeti samo pozitivnih nabojev; Zato elektroni krožijo okoli jedra, da jo nevtralizirajo.
 Osnovna struktura atoma: glavni subatomski delci
Osnovna struktura atoma: glavni subatomski delci Tako je za vsak proton, ki doda. Na ta način je novi dodani elektron, diferencialni elektron tesno povezan z atomsko številko Z.
Diferencialni elektron najdemo v najbolj oddaljeni elektronski plasti: plast Valencije. Zato je dlje jedro, večja je energija, povezana z njim. Ta energija je odgovorna za njeno udeležbo in tudi preostale elektrone Valencije, v kemičnih reakcijah, značilnih za elemente.
[TOC]
Kvantne številke
Poleg preostalih elektronov lahko diferencialni elektron prepoznamo s svojimi štirimi kvantnimi številkami. Kakšne so kvantne številke? So "n", "l", "m" in "s".
Kvantna številka "N" označuje velikost ravni atoma in energije (K, L, M, N, OR, P, Q). "L" je sekundarna ali acemutalna kvantna številka, ki označuje obliko atomskih orbitalov in za orbitale "S", "P", "D" in "f ", oziroma.
Lahko vam služi: aforirana bučka: značilnosti, za kaj je, tipi, uporablja"M" je magnetno kvantno število in označuje prostorsko orientacijo orbital pod magnetnim poljem. Tako 0 za orbitalno "S"; -1, 0, +1, za orbitalno "p"; -2, -1, 0, +1, +2, za orbitalno „d“; in -3, -2, -1, 0, +1, +2, +3, za orbitalno "f". Končno je kvantno število spin "S" (+1/2 za ↑ in -1/2 za ↓).
Zato je diferencialni elektron povezal prejšnje kvantne številke ("n", "l", "m", "s"). Ker nasprotuje novi pozitivni obremenitvi, ki jo ustvari dodatni proton, zagotavlja tudi atomsko število Z elementa.
Kako vedeti diferencialni elektron?
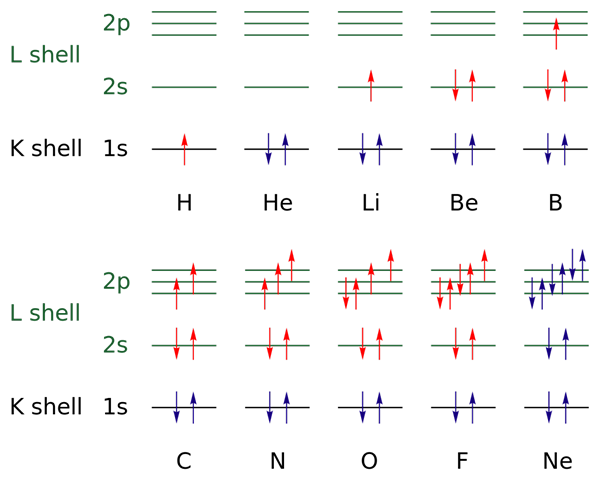
Na zgornji sliki so za elemente od vodika do neonskega plina predstavljene elektronske konfiguracije (H → NE).
V tem so elektroni odprtih plasti označeni z barvo rdeče, medtem ko so tisti iz zaprtih plasti označeni z barvno modro. Plasti se nanašajo na kvantno številko "n", prvo od štirih.
Na ta način konfiguracija Valencije H (↑ rdeče) doda še en elektron z nasprotno orientacijo, da postane končnika HE (↓ ↑, oba modra, ker je zdaj stopnja 1 zaprta). Ta dodani elektron je nato diferencialni elektron.
Tako lahko opazimo, kako diferencialni elektron doda valenčno plast (rdeče puščice) od elementov in jih razlikuje drug od drugega. Elektroni napolnijo orbitale, ki spoštujejo pravilo umivalnika in načelo izključitve Paulinga (odlično opaženo od B do NE).
Kaj pa kvantne številke? Te določijo vsako puščico - torej vsak elektron - in njegove vrednosti je mogoče potrditi z elektronsko konfiguracijo, da vemo, ali so tisti iz diferencialnih elektronov ali ne.
Lahko vam služi: kakšni so negativni učinki, ki jih imamo z topnostjo vode?Primeri diferencialnih elektronov v več elementih
Klor
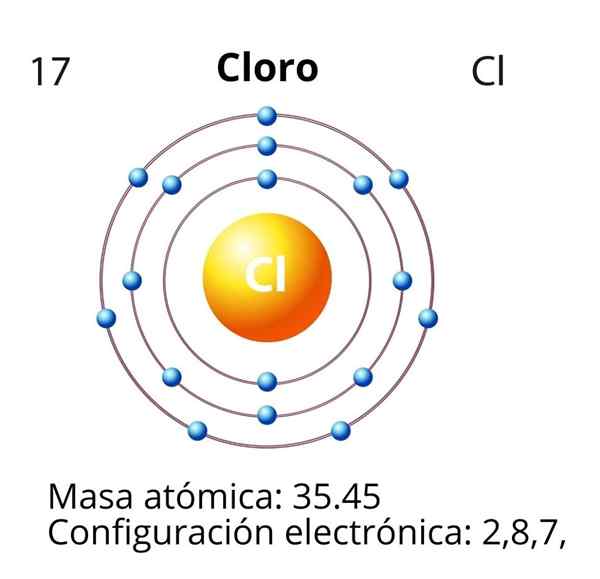
V primeru klora (CL) je njegovo atomsko število z enaka 17. Elektronska konfiguracija je nato 1s22s2sp63s23P5. Orbitale, označene z rdečo barvo, ustrezajo tistim iz plasti Valencije, ki prikazuje stopnjo 3 odprte.
Diferencialni elektron je zadnji elektron, ki je nameščen v elektronski konfiguraciji, atom klora pa je 3P orbital, katerega razpoloženje je naslednje:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Ob spoštovanju pravila umivalnika so 3P orbitale najprej napolnjene z enako energijo (puščica navzgor v vsaki orbitali). Drugič, drugi elektroni parijo z osamljenimi levo v desne elektrone. Diferencialni elektron je predstavljen v zelenem okvirju.
Tako ima diferencialni elektron za klor naslednje kvantne številke: (3, 1, 0, -1/2). To je, "n" je 3; "L" je 1, orbitalno "p"; "M" je 0, ker gre za orbitalno "p" medija; In "S" je -1/2, saj puščica kaže.
Magnezij
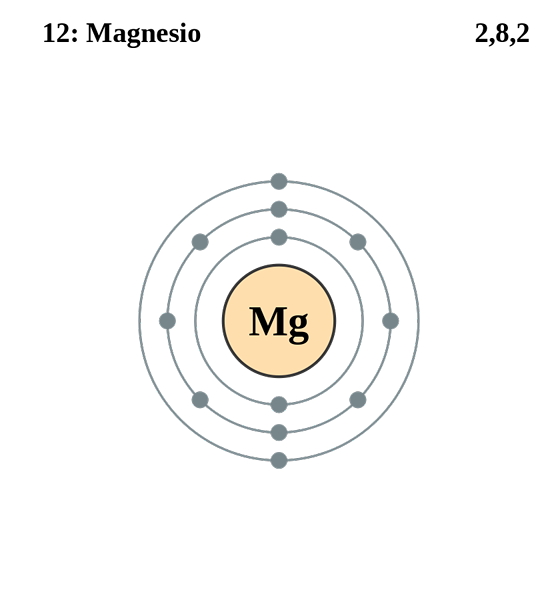 Elektronska konfiguracija magnezija. Vir: electron_shell_012_magnezij.SVG: Pumbaa (izvirno delo Grega Robsona) Derivatno delo: Kizar, CC BY-SA 3.0, prek Wikimedia Commons
Elektronska konfiguracija magnezija. Vir: electron_shell_012_magnezij.SVG: Pumbaa (izvirno delo Grega Robsona) Derivatno delo: Kizar, CC BY-SA 3.0, prek Wikimedia Commons Elektronska konfiguracija za magnezijev atom je 1S22s2sp63s2, Na enak način predstavlja orbital in njegov elektron Valencia:
↑ ↓
3s
0
Tokrat ima diferencialni elektron kvantne številke 3, 0, 0, -1/2. Edina razlika v tem primeru glede na klor je, da je kvantna številka "L" 0, ker elektron zaseda orbitalno "S" (3s).
Circonio
Elektronska konfiguracija za cirkonijev atom (prehodna kovina) je 1S22s2sp63s23P64s23D104p65s24d2. Na enak način, kot je prejšnji primeri zastopanost orbitalov in elektronov Valencije naslednja:
Lahko vam služi: ciklopentano (C5H10): struktura, lastnosti in uporabe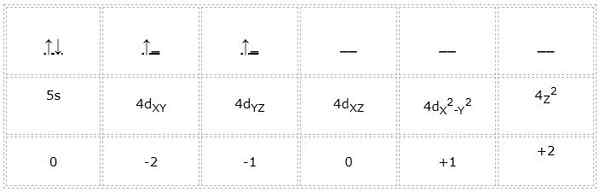
Tako so kvantne številke za diferencialni elektron, označeni z zeleno,: 4, 2, -1, +1/2. Tukaj, ko elektron zaseda drugo orbitalno "D", ima kvantno številko "M" enako -1. Tudi zato, ker puščica kaže navzgor, je njegova vrtelna številka "S" enaka +1/2.
Neznani element
Kvantno število diferencialnih elektronov za neznani element je 3, 2, +2, -1/2. Kaj je atomska številka z elementa? Poznavanje z lahko dešifrira, kaj je element.
Tokrat, kot je "n" isto 3, pomeni, da je element v tretjem obdobju periodične tabele, z "D" orbitali kot plast Valencia ("l" enako 2). Zato so orbitale predstavljene kot v prejšnjem primeru:
↑ ↓ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Kvantne številke "m" so enake +2 in "s" enako -1/2, so ključne za pravilno iskanje diferencialnega elektrona v zadnji 3D orbitali.
Tako ima element, ki ga iščejo10 polno, kot njene notranje elektronske plasti. Za zaključek je element kovinski cink (Zn).
Vendar kvantno število diferencialnih elektronov ne more razbrati med cinkom in bakrom, ker ta zadnji element predstavlja tudi 3D orbitale polne. Ker? Ker je baker kovina, ki iz kvantnih razlogov ne uspe s pravili, napolnjenimi z elektroni.
Reference
- Jim Branson. (2013). Pravila umivalnika. Pridobljeno iz QuantumMechanics.UCSD.Edu
- Predavanje 27: Pravila umivalnika. Okreval od pH.Qmul.AC.Združeno kraljestvo
- Univerza Purdue. Kvantne številke in konfiguracije elektronov. Pridobljeno iz Murmerja.Kem.Purdue.Edu
- Salvat Enciklopedija znanosti. (1968). Salvat fizika, s.Do. iz Editions Pamplona, letnik 12, Španija, str. 314–322.
- Walter J. Moore. (1963). Fizikalna kemija. V Delci in valovi. Četrta izdaja, Longmans.

