Natrijev karbonat (NA2CO3)
- 2027
- 401
- Ignacio Barrows
Pojasnjujemo, kaj so natrijev karbonat, njegove fizikalne in kemijske lastnosti, struktura in aplikacije
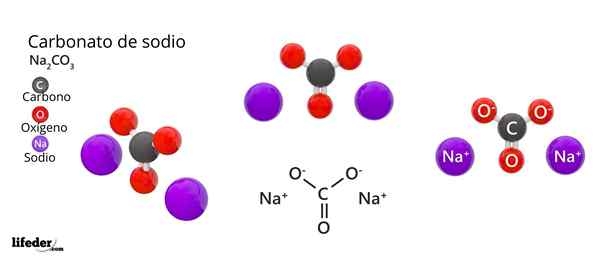
 Natrijeva karbonatna struktura in formula
Natrijeva karbonatna struktura in formula Kaj je natrijev karbonat?
On natrijev karbonat (Na2Co3) Gre za anorgansko sol, alkalno kovino in ogljikovo kislino. Po vsem svetu je znan tudi kot Sosa Ash. Jezera in vulkanske dejavnosti so obogatile tla natrija, od katerih so rastline hranili; Nato te rastline po požaru širijo karbonatni pepel.
Kako nastane ta kovinska natrijeva sol? Čisti natrij ima konfiguracijo Valencije [NE] 3S1. 3S orbitalni elektron1 Z lahkoto ga ločijo drugi elementi narave (kot so žveplo, kisik, klor, fluor itd.), ki tvorijo mineralne spojine, kjer sodeluje stabilen ion NA+.
Na+ Spremljajo ga druge ionske vrste v teh trdnih snovi; Od tega je natrijev karbonat le še en prisoten v naravi. Od takrat je v vseh časih uporabila vse civilizacije. Te civilizacije so ugotovile, da so sivi prah koristni za svoje domove in ljudi.
Te lastnosti so zaznamovale njihovo uporabo, ki danes ohranjajo tradicionalne vidike preteklosti, druge.
Natrijev karbonat je po naravi zelo bogat in morda tudi na drugih ozemljih zunaj planeta Zemlje, kot so nekatere lune sončnega sistema.
Formula
Kemična formula natrijevega karbonata je na2Co3. Kako se razlaga? To pomeni, da v kristalni trdni snovi za vsak co -ion32- Obstajata dva iona NA+.
Natrijeva karbonatna struktura
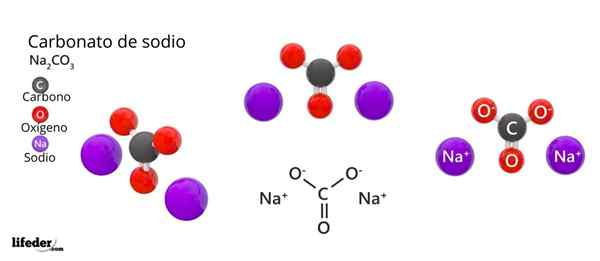
Na zgornji sliki je predstavljena struktura NA2Co3 Anhidrid (imenovan tudi Sosa Calcinada). Vijolične sfere ustrezajo ioni NA+, medtem ko črna in rdeča do ionov co32-.
Karbonatni ioni imajo ravno trigonalno strukturo, z atomi kisika na svojih točkah.
Lahko vam služi: cimamična kislina: struktura, lastnosti, pridobivanje, uporabeSlika daje panoramo, ki jo vidimo iz višje ravnine. Na ioni+ Obkrožene jih s šestimi atomi kisika, iz Co -ionov32-. To je v NA2Co3 Anhidrid Natrij se sreča z oktaedrsko koordinacijsko geometrijo (zaklenjena je v središču oktaedra).
Vendar je ta struktura sposobna tudi namestiti molekule vode, ki komunicira z vodikovimi mostovi z vrhovi trikotnikov.
Pravzaprav na hidrira2Co3 (Na2Co3· 10H2Ali, na2Co3· 7h2Ali, na2Co3· H2Ali in drugi) so večje številčnosti kot anhidridna sol.
Termonatrit (NA2Co3· H2O), Natron (Na2Co3· 10H2O) in trona (NA3(HCO3) (Co3) · 2H2Ali so glavni naravni viri natrijevega karbonata, zlasti minerala Trone, predstavljeni na prvi sliki.
Uporaba/uporaba natrijevega karbonata
Natrijev karbonat izpolnjuje številne funkcije v ljudeh, gospodinjstvih in industriji, med temi funkcijami pa izstopajo:
- Natrijev karbonat se uporablja v številnih čistilnih izdelkih. To je posledica njegove razkužilne zmogljivosti, moči za raztapljanje maščob in njihove lastnine za mehčanje vode. Je del detergentov, ki se uporabljajo v pralnicah, samodejnem pomivalnem stroju, čistem steklu, mešanju lis, belilnikov itd.
- Karbonatno razkužilo se lahko uporablja na trdih površinah, kot so tla, stene, porcelan in kadi, z izjemo Fiberglass in aluminij, ki ga lahko opraska.
- Uporablja se v nekaterih živilih, da se izognete skodelici, ki se lahko pojavi v teh.
- Prisoten je v več izdelkih za osebno nego, kot so kopeli z mehurčki, zobne testenine in mila.
- Uporablja se v stekleni industriji zaradi svoje sposobnosti razgradnje silikatov.
- Uporablja se pri vzdrževanju bazenov, kjer izpolnjuje razkužilo in regulativno funkcijo pH.
- Pri ljudeh terapevtsko se uporablja pri zdravljenju kislosti in dermatitisa.
- V veterinarski medicini se uporablja pri zdravljenju čiščenja obročev in kože.
Sinteza natrijevega karbonata

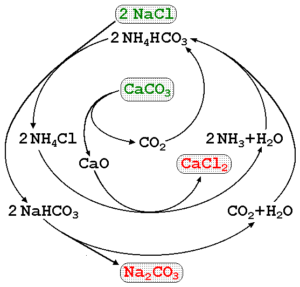
Natrijev karbonat je mogoče izdelati z uporabo slanice morja in apnenca (Caco3) V procesu Solvay. Na vrhunski sliki je prikazan procesni diagram, ki poudarja proizvodne poti, pa tudi reagente, posrednike in izdelke. Reagenti so napisani z zelenimi črkami in izdelki z rdečimi črkami.
Spremljanje teh reakcij je lahko nekoliko zapleteno, vendar globalna enačba, ki kaže samo na reagente in izdelke, je:
2nacl (aq) + caco3(s) na2Co3(s) + cacl2(AC)
Caco3 Ima zelo stabilno kristalno strukturo, zato nenehno zahteva veliko energije, da jo razgradi v CO2. Poleg tega ta postopek ustvarja velike količine CACL2 (kalcijev klorid) in druge nečistoče, katerih izpusti vplivajo na kakovost vode in okolje.
Obstajajo tudi druge metode proizvodnje natrijevega karbonata na industrijskih poljih, kot sta procesi HOU in LeBlanc.
Danes je njegovo pridobivanje iz naravnih mineralov trajnostno, Trona pa je najpogostejša od njih.
Po drugi strani je bila najbolj tradicionalna metoda sestavljena iz gojenja in izgorevanja rastlin in alg, bogatih z natrijem. Nato smo pepel kopali z vodo in ga ogrevali do izdelka. Od tu se je pojavil znani pepel Sosa.
Natrijeve karbonatne lastnosti
Na2Co3 Je higroskopska bela trdna trdna, stranišče, z molekulsko maso 106 g/mol in gostoto 2,54 g/ml pri 25 ° C.
Njene lastnosti se spreminjajo, ko molekula vode vključuje v kristalno strukturo. Ker lahko voda tvori vodikove mostove in ioni med njimi "odprt prostor", se količina stekla poveča in gostota hidrata se zmanjša. Na primer za NA2Co3· 10H2Ali pa je njegova gostota 1,46 g/ml.
Vam lahko služi: reverzibilna reakcija: značilnosti in primeriNa2Co3 taljenja pri 851 ° C, ki se razgradi v skladu z naslednjo enačbo:
Na2Co3(s) => na2Ali (s) + co2(g)
Spet, kljub ionom32- in na+ Se razlikujejo po velikostih, njihove elektrostatične interakcije so zelo učinkovite in vzdržujejo stabilno kristalno omrežje.
Molekule vode "ovirajo" te interakcije in posledično so hidrati bolj dovzetni za razgradnjo kot anhidrid.
To je osnovna sol; to pomeni, da raztopljeno v vodi ustvari raztopino s pH, večjim od 7. To je posledica hidrolize co32-, čigar reakcija sprošča oh- v sredini:
Co32-(Ac) + h2Ali (l) HCO3-(AC) + OH-(AC)
Je zelo topen v vodnih in polarnih topilih, kot so glicerol, glicerin, aceton, acetati in tekoči amonijak.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. V elementih skupine 1. (Četrta izdaja., str. 265). MC Graw Hill.
- Scifun.org. (2018). Natrijev vodikov karbonat in natrijev karbonat. Okreval od Scifun -a.org
- Wikipedija. (2018). Natrijev karbonat. Pridobljeno iz.Wikipedija.org
- Pubchem. (2018). Natrijev karbonat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Ciner Resources Corporation. (2018). Soda pepel. Ciner si je opomogel.nas.com
- Peltier k. (3. julij 2018). Vse, kar morate vedeti o natrijevem karbonitu. Pridobljeno 8. aprila 2018, od: ThesPruce.com
- Neto industrija. (2018). Natrijev karbonat - Uporaba natrijevega karbonata. Pridobljeno 8. aprila 2018, od: znanost.Jank.org

