Šibka kislina
- 3244
- 190
- Barry Ernser
 Primeri šibkih kislin
Primeri šibkih kislin Kaj je šibka kislina?
Šibka kislina je tista, ki ima v vodni raztopini malo sposobnosti za disociiranje v vodiku (H+) in v ustrezni konjugirani bazi. Za razliko od močnih kislin, katerih disociacija je popolna (100%) in praktično nepopravljiva, šibke kisline komaj disociirane in reverzibilne.
Zato šibka kislina ustvari manj hones h+ V vodi, kar bi bilo pričakovati. Med najbolj reprezentativnimi šibkimi kislinami imamo ocetno kislino, glavno sestavino kisa, ki je približno v 0.5 % v normalnih pogojih.
To pomeni, da je največji delež raztopine ocetne kisline v vodi, kot je 5%kuhalni kis3Cooh); Medtem ko je majhen del najdemo kot konjugacijsko bazo (izberite3COO-), ki jih spremljajo H ioni+, ali bolj pravilno, h ioni3Tudi+.
Potem, ker je količina vodika, ki jo sprošča šibka kislina v vodni raztopini, nizka, je pH, ki ga proizvajajo. Na primer, kis ima pH 2.5, pomarančni sok pH 3.3. 4.2 in 2 limonini sok 2.
Ti pH, čeprav so kisli, so višji od pH, ki proizvajajo raztopino močne kisline (HCl, H2SW4, itd.) da lahko dosežejo vrednost 1 ali manj (negativne pH vrednosti).
Značilnosti šibkih kislin
pH vaših rešitev
Šibke kisline imajo običajno pH med 2.0 in manj kot 7.0, zato barvo papirja Pannasol obrnejo v rdečo. Te pH vrednosti so veliko višje od pH vrednosti, ki jih proizvajajo močne kisline, čeprav obstajajo izjeme.
Na primer, 1 mm raztopina klorovodikove kisline (močna kislina) ima pH 3.0, medtem ko 1 mM raztopina fluorhorične kisline ("šibka" kislina) ima pH 3.2, ki je blizu močne kisline.
Delna ionizacija
Šibke kisline v raztopini so ionizirane malo ali delno v vodi, ki disocirajo v konjugirani bazi kisline in vodikovega iona. Nato se večinoma loči šibka kislina v vodni raztopini z majhnim disociiranim deležem.
Vam lahko služi: uravnoteženje kemijskih enačbKo je količina vodika, ki jo sprošča šibka kislina v vodi, nizka, je pH, ki ga proizvaja ta kislina.
Reverzibilna ionizacija
Ionizacija šibke kisline je običajno shematizirana na naslednji način:
Ima ⇌ a- + H3Tudi-
Kje je šibka kislina- njegova konjugirana baza in h3Tudi+ hidronijev kation, ki je pot v h+ Obstaja ali se manifestira v vodi. Koncentracija (ali aktivnost) h3Tudi+ Uporablja se namesto H+ Za določitev raztopine raztopine.
Stopnja ionizacije
Nekatere kisline so šibkejše od drugih, kar je enako, da so manj ionizirane. Zato nam stopnja ionizacije omogoča, da v določenih pogojih pogledamo, kako kisla je kislina.
Za izražanje stopnje ionizacije je bilo uvedenih več parametrov, kot sta ionizacijska ali kislonska konstanta (KA) in PKA: način izražanja KA v preprostem številu, ki izpušča uporabo števila, izražene v negativnih moči (10 ), kot obstaja v KA.
Konstante KA in PKA se uporabljajo predvsem za šibke kisline.
Ka = [a-] [H+] / [Ha]
Oklepaji, ki so prisotni v formuli, predstavljajo koncentracije.
pKA = - dnevnik ka
Vrednost PKA šibke kisline se običajno giblje med 2 in 12. Vendar obstajajo izjeme. Na primer: in in odagična kislina (HIO3) ima PKA 0.77, ki velja za razmeroma majhno vrednost, vendar brez negativnega, za šibko kislino v strogih smislu.
Stabilnost konjugata
Šibke kisline imajo močno vez s kislim vodikovim atomom (Hδ+-Xδ-), zato imajo nizko stopnjo disociacije vodika. Posledica tega je, da ima konjugirana baza šibke kisline veliko avidnost z vodikom, saj je močna konjugirana baza.
Vam lahko služi: koloidTo pomeni, da je konjugirana osnova šibke kisline zelo nestabilna, ker sprejema h+ vrnil zelo enostavno. Bolj nestabilna ta konjugirana baza, šibkejša bo kislina.
Nizka ionska prevodnost
Ker so malo ionizirane, šibke kisline slabi električni prevodniki, za razliko od močnih kislin, ki so dobri električni prevodniki.
Prisotnost v naravi
Šibke kisline so v naravi široko razporejene, na primer so v citrusih (limona, grenivka, pomaranča itd.).
Prisotni so tudi v številnih procesih, ki se pojavljajo pri vseh živih bitjih. Nekatere od teh bioloških šibkih kislin so piruvične, mlečne, citronske, fumarične, sukcinične, glutamične itd., in celo oksigenirani hemoglobin sprošča vodive, zato se obnaša kot šibka kislina.
Nato je mogoče sklepati, da človek živi v stalnem stiku s šibkimi kislinami.
Kako izračunati pH šibke kisline?
PH šibke kisline lahko izračunamo z uporabo kisline konstante (KA) ali z uporabo enačbe Henderson-Haselbalch. V prvem primeru bo uporabljen KA.
S konstanto kislosti
Izračunajte pH raztopine 0.5 m benzojske kisline (c6H5COOH), ki ima ionizacijsko konstanto (ka) = 1.8 x 10-5
C6H5COOH ⇌ c6H5COO- + H+ (1)
Če se količina kisline, ki se disociira, imenuje x, potem 0.5 M-X bo koncentracija šibke kisline, ki se ne disocinira v ravnotežju, koncentracija konjugatne baze benzojske kisline in koncentracije vodikovih ionov.
Enačba (1) je lahko predstavljena na naslednji način:
0.5 m-x ⇌ x +x
Šibke kisline so ionizirane v zelo nizek delež, zato koncentracija benzojske kisline v ravnovesju (0.5 m-x), lahko domnevamo kot 0.5 m, saj x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5M)
X = 3 x 10-3 M
Zato [h+] je enak 3 x 10-3 M. Nato rešimo z izračunom pH:
Lahko vam služi: Mohr metoda: osnove, reakcije, postopek, uporabepH = - dnevnik [h+]
= - dnevnik [3 x 10-3]
pH = 2.52
Upoštevajte, da je pH razmeroma kisel, saj se nahaja pod 3 ali 4.
Z enačbo Henderson-Haselbalch
Henderson-Haselbalch enačba se uporablja za izračun pH puferske raztopine:
pH = pKA + log [konjugirana baza] / [kislina]
Primer:
Natrijevi hidroksid (NaOH) se doda v raztopino ocetne kisline, ki daje končno koncentracijo ocetne kisline (CH3COOH) 1.11 x 10-2 mol/l in konjugirana koncentracija baze (izberite3COO-) od 0.44 x 10-2 mol/l. Če je ocetna kislina PKA 4.75 Izračunajte pH raztopine.
pH = 4.75 +dnevnik [a-] / [Ha]
pH = 4.75 +dnevnik (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ dnevnik 0.396
= 4.348
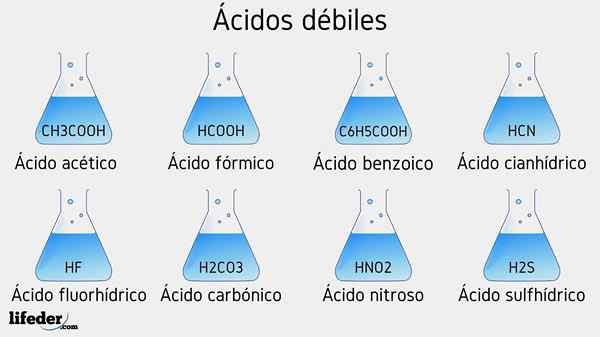
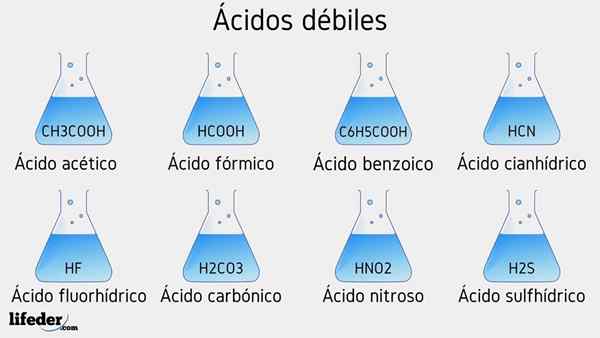
Primeri šibkih kislin
Spodaj bo navedenih več šibkih kislin, ki jih spremljajo njihove vrednosti PKA:
- Pogl3COOH (ocetna kislina), PKA 4.75
- HCOOH (mravljična kislina), PKA 3.74
- C6H5COOH (benzojska kislina), PKA 5.59
- Pogl2CLCOOH (kloroocetna kislina), PKA 2.85
- HCN (cianhidrična kislina), PKA 9.31
- Hf.17
- C2H5COOH (propionska kislina), PKA 4.89
- Hno2 (Dušikova kislina), PKA 3.35
- H2S (sulfidna kislina), PKA1 6.0 in PKA2 12.92
- CCL3COOH (trikloroocetna kislina), PKA 0.52
- H2Co3 (ogljikova kislina), PKA1 6.37 in PKA2 10.22
- H3Po4 (fosforna kislina), PKA1 2.12, PKA2 4.21 in PKA3 enajst.0
- C6H5SW3H (benzefonska kislina), PKA 0.70
- Hio3 (Yodijeva kislina), PKA 0.77
- Hclo2 (Kloro kislina), PKA 2.0
- Pogl3Pogl2(OH) COOH (mlečna kislina), PKA 3.08
Šibke kisline s terapevtsko uporabo
- Salicilna kislina, PKA 3.00
- Acetilsalicilna kislina, PKA 3.49
- Furosemide, PKA 3.90
- Ibuprofen, PKA 4.40
- Levodopa, PKA 2.30
- Fenobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Morris, J. G. (1974). Fizikalnokemija za biologe. (2. izd.). Sem se obrnil.
- Čelada, Anne Marie, ph.D. (29. avgust 2020). Šibka kislinska definicija in primer v kemiji. Okreval od: Thoughtco.com
- Ophardt c., & McCarthy l. (15. avgust 2020). Kislina in osnovna trdnost. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Clark Jim. (2013). Močna in šibka kislina. Okrevano od: Chemguide.co.Združeno kraljestvo
- Lumen učenje. (s.F.). Kemija za ne-majore: izračun pH šibkih kislinskih in osnovnih raztopin. Obnovi se od: tečajev.Lumenarning.com

