Zgodovina, struktura, lastnosti, uporabe

- 3827
- 423
- Don Nitzsche
On Berlij To je kovinski element, ki spada v skupino 2 ali Iia periodične tabele. Je najbolj lahka alkalna kovina v skupini in jo predstavlja simbol BE. Njegov atom in kation sta tudi manjša od njih pri vrstnikih (MG, CA, MR ...).
Zaradi svoje nenavadne gostote obremenitve se ta kovina običajno ne pojavi v izolaciji. Poznajo približno 30 mineralov, ki jih vsebujejo, med katerimi so: Beryl (3Beo · al2Tudi3· 62· 2H2O), Bertrandita (4Beo.2SE2.2H2O), El Chrisobereilo (Beal2Tudi4) in fenaquita (biti2Ja4).
 Kovinske beryll pipitas. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Kovinske beryll pipitas. Vir: w. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] La esmeralda, dragoceni kamen, je različica Beryl. Vendar čisti berilij ni tako presenetljiv; Izgleda bledo sivkasto svetlost (nadrejena podoba) in je bila dosežena v obliki Pepitas ali Dragees.
Berlij ima niz značilnih fizičnih lastnosti. Ima nizko gostoto; Visoko toplotno in električno vedenje, pa tudi njegova toplotna sposobnost in odvajanje toplote; Ni magnetna kovina; in ima tudi primerno kombinacijo togosti in elastičnosti.
Vse te lastnosti so privedle do tega, da je bil Berlij kovina s številnimi aplikacijami, od njegove uporabe v bakrenih zlitinah za izdelavo orodij, do uporabe v raketah, letalih, avtomobilih, jedrskem reaktorju, resonančni opremi, resonančni jedrski magnetni itd. .
Berlij ima 10 znanih izotopov, ki segajo od 5Biti 14Biti, biti 9Biti edini hlev. Je tudi zelo strupena kovina, ki še posebej vpliva na dihalni sistem, zato je pri njegovi uporabi omejitev.
[TOC]
Zgodovina vašega odkritja
Berilija je Louis-Nicolas Vauguelin odkril leta 1798 kot kompozicijski element minerala Berilo ter aluminij in berilijev silikat.
Nato je nemški kemik Frederic Wöhler leta 1828 uspel izolirati berilij z reakcijo s kalijem z berilijevim kloridom v platinasti loncu.
Hkrati in neodvisno je francoski kemik Antoine Bussy dosegel tudi izolacijo berilija. Wöhler je prvi predlagal ime Berylium za kovino.
Svoje ime je prejel v letu 1957, saj je bil prej znan kot Glucinium, zaradi sladkega okusa nekaterih soli. Toda, da bi se izognili zmedi z drugimi sladkimi okusnimi spojinami in z rastlino, imenovano Glucina.
Berily struktura
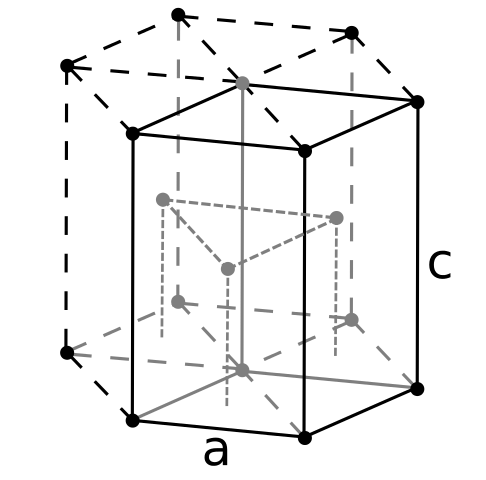 Berily Crign Struktura. Vir: Uporabnik: Dornelf [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Berily Crign Struktura. Vir: Uporabnik: Dornelf [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Ker je Beryl najlažji od alkalinoternih kovin, je treba pričakovati, da bo prostornina njegovih atomov najmanjša od vseh. Atomi Beerlil medsebojno sodelujejo skozi kovinsko vez, tako da je njihovo "morje elektronov" in odbojnosti med modelom jeder, ki je nastala s stekleno strukturo.
Lahko vam služi: periódinska kislina (HIO4): kaj je, struktura, lastnosti, uporabeNato se oblikujejo črni kristali berilija. Ti kristali imajo šesterokotno strukturo (vrhunsko podobo), kjer ima vsak šest stranskih sosedov in tri druge v ravninah zgoraj in navzdol.
Ker je črni kristali, je koristno. To je ena najbolj kompaktnih struktur, ki jo lahko sprejme kovina; In smiselno je, da se tako majhni atomi "stisnejo" oboje, da se izognejo najmanj praznine ali števila lukenj med njimi.
Elektronska konfiguracija
1s22s2
Kaj je enako 4 elektroni, od tega 2 iz Valencije. Če se spodbuja elektron v orbitalo 2p, bosta imela dve SP Hbíbridos orbitali. Tako lahko v berilijevih spojinah obstajajo linearne geometrije, x-be-x; Na primer izolirana molekula Becl2, Cl-be-cl.
Lastnosti
Fizični opis
Trdno siva, svetla in krhka barva.
Tališče
1287 ° C.
Vrelišče
2471 ° C.
Gostota
- 1.848 g/cm3 pri sobni temperaturi.
- 1,69 g/cm3 do tališča (tekoče stanje).
Atomski radio
232 PM.
Radijski kovalent
21.00.
Atomski volumen
5 cm3/mol.
Specifična toplota
1,824 j/g · mol pri 20 ° C.
Fuzijska toplota
12,21 kJ/mol.
Toplota izhlapevanja
309 kJ/mol.
Elektronegativnost
1,57 na lestvici Pauling.
Standardni potencial
1,70 v.
Hitrost zvoka
12.890 m/s.
Toplotno raztezanje
11,3 µm/m · K pri 25 ° C.
Toplotna prevodnost
200 w/m · k.
Kemične lastnosti
Berlij je prekrit s plastjo beril oksida (čebele), ki služi kot zaščita zraka pri sobni temperaturi. Oksidacija berilija se pojavi pri temperaturah, večjih od 1000 ° C, ki izvirajo kot proizvodi berilijevega oksida in berilijevega nitrida.
Prav tako je odporen na delovanje dušikove kisline 15 m. Toda raztopi se v klorovodiki in alkaliji, kot je natrijev hidroksid.
Prijave
Priprava orodij
Berlij tvori zlitine z bakrom, nikljem in alumino. Zlasti zlitina z bakrom proizvaja orodja velike trdote in odpornosti, kar predstavlja le 2% teže zlitine.
Ta orodja ne proizvajajo iskric, ko zadenejo železo, kar jim omogoča uporabo v okoljih z visoko vsebnostjo gorljivih plinov.
Vam lahko služi: toplotna: struktura, značilnosti, tvorba, primeriZaradi nizke gostote ima lahko težo, ki skupaj s svojo togostjo omogoča njegovo uporabo v vesoljskih zrakoplovih, raketah, raketah in letalskih mestih. Zlitina z berilijem je bila uporabljena pri izdelavi avtomobilskih delov. Uporablja se tudi v izdelavi Springs.
Zaradi velike trdote, ki jo je Berlij podelil svojim zlitinam, so bile uporabljene v zavorah vojaških zrakoplovov.
Izdelava ogledal
Berlijski je bil uporabljen pri proizvodnji ogledal zaradi svoje dimenzijske stabilnosti in sposobnosti, da ima visok pulter. Ta ogledala se uporabljajo v satelitih in sistemih za nadzor požara. Poleg tega se uporabljajo vesoljski teleskopi.
Pri ionizirajočem sevanju
Berlij je element z nizko gostoto, zato se lahko šteje. Ta funkcija omogoča njegovo uporabo pri izdelavi oken cevi, ki proizvajajo X -trays, industrijsko uporabo in medicinsko diagnozo.
Prav tako se v oknih radioaktivnih emisijskih detektorjev uporablja berilij.
V ekipah za generiranje magnetizma
Med značilnostmi berilija ni magnetni element. To omogoča, da se uporabi pri izdelavi izdelkov magnetne resonančne opreme, v katerih se ustvarijo magnetna polja velike intenzivnosti, kar minimizira kakršno koli interferenco.
Jedrski reaktorji
Zaradi svoje visoke fuzijske točke je našel uporabo v jedrskih reaktorjih in keramiki. Berillium se uporablja kot moderator jedrskih reakcij in kot nevtronski proizvajalec:
9Biti + 4On (α) => 12C +N (nevtron)
Ocenjujejo, da se za milijon berilnih atomov, ki jih bombardiramo z α delci, pojavi do 30 milijonov nevtronov. Natančno ta jedrska reakcija je omogočila odkritje nevtrona.
James Chadwick je bombardiral atome beril z α delci (HE). Raziskovalec je opazil sproščanje subátomskih delcev brez električnega naboja, kar je privedlo do odkritja nevtronov.
Kovinski zaščitnik
Na površino kovin, ki jih je mogoče oksidirati, dodajte količino berilija, da določeno zaščito. Na primer, vnetljivost magnezija se zmanjša in svetlost srebrnih zlitin se podaljša.
Kje je?
Beryl najdemo v pegmatitu, povezan s MICA, Feldspar in kremen. Z uporabo tehnike flotacije je mogoče ločiti mešanico Beryl in Feldspar. Nato sta Feldspar in Beryl koncentrirana in podvržena zdravljenju s kalcijevim hipokloritom.
Lahko vam služi: razlike med organskimi in anorganskimi spojinamiSledi zdravljenje z žveplovo kislino in kalijevim sulfonatom, z redčenjem je dosežena berilna flotacija, ki jo loči od Feldspar.
Beryl se zdravi z natrijevim fluorozilikom in sodo pri 770 ° C, da tvori natrijev fluoroberat, aluminijev oksid in silicijev dioksid. Nato oborimo berilijev hidroksid raztopine natrijevega hidroksida hidroksida hidroksida.
Berillijev fluorid nastane z reakcijo berilnega hidroksida z amoniakalnim vodikovim fluoridom, ki proizvaja amonijev amonij. To se segreje, da tvori berilijev fluorid, ki ga obdelamo z vročim magnezijem za izolacijo berilija.
Tveganja
Berlij kot fino razdeljen kovina, v obliki raztopin, suhega prahu ali dima, je zelo strupen in lahko proizvaja dermatitis. Vendar največja strupenost nastane z vdihavanjem.
Sprva lahko berilij povzroči preobčutljivost ali alergijo, kar lahko postane bellioza ali kronična bolezen berilija (CBD). To je resna bolezen, za katero je značilno zmanjšanje zmogljivosti pljuč.
Akutna bolezen je redka. Pri kronični bolezni je po telesu tvorba faruloma, zlasti v pljučih. Kronična belioza povzroča progresivno dispnejo, kašelj in splošno šibkost (Astenija).
Akutna belioza je lahko smrtna. Pri belliozi pride do progresivne izgube dihalne funkcije, saj je ovira pretok dihalnih poti v dihalnih poteh in znižana oksigenacija krvnega krvnega tlaka.
Reference
- Royal Society of Chemistry. (2019). Berlij. Okrevano od: RSC.org
- Nacionalni center za informacije o biotehnologiji. (2019). Berlij. Baza podatkov Pubchem. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Čelada, Anne Marie, ph.D. (15. marec 2019). Dejstva o beriliju. Okreval od: Thoughtco.com
- Wikipedija. (2019). Berlij. Pridobljeno iz: v.Wikipedija.org
- Lentech b. V. (2019). Berlij-bit. Okrevano od: Lentech.com
- Korporacijsko gradivo. (2019). Spoznajte element Beryllium, ki je bil obnovljen od: Berlij.com
- D. Michaud. (12. april 2016). Problem za obdelavo in pridobivanje berilja. 911 metalurgist. Okrevano od: 911metallurgist.com
- Timotej str. Hanusa. (5. januar 2016). Berlij. Encyclopædia Britannica. Okrevano od: Britannica.com
- Branje s. Newman. (2014). Berlijska bolezen. MSD Priročnik. Okrevano od: msdmanuals.com
- « Zgodovina, cilji in profili športne psihologije
- Socialna globalizacija družbena dimenzija, prednosti in primeri »

