Acrilonitril struktura, lastnosti, proizvodnja, uporabe

- 2964
- 860
- Ignacio Barrows
On acrilonitrile Je organska spojina, katere kondenzirana formula je CHO2Chcn. Je eden najpreprostejših nitrilov, ki obstajajo. Kemija in strukturno to ni nič drugega kot produkt zveze med vinilno skupino, Cho2= Ch-, in nitril, cianidna skupina, C≡N. To je snov z velikim industrijskim vplivom na svet plastike.
Fizično je brezbarvna tekočina, z določenim vonjem čebule in v nečistem stanju predstavlja rumenkaste tone. Je zelo vnetljiv, strupen in morda rakotvoren, zato je razvrščena kot izjemno nevarna snov. Ironično je, da so z njo izdelani plastika in igrače vsakdanjega življenja, kot sta tupperware in Lego bloki.
 Akrilonitrilni polimeri so prisotni v plastiki Tupperware. Vir: Stebulus prek Wikipedije.
Akrilonitrilni polimeri so prisotni v plastiki Tupperware. Vir: Stebulus prek Wikipedije. Na industrijskih lestvicah acrilonitril. Skoraj vsa proizvedena količina je namenjena proizvodnji plastike, ki temelji na homopolimerih, kot so poliakrilonitril, ali v kopolimerih, kot so akrilonitril-butadien-stiren.
[TOC]
Acrilonitril struktura
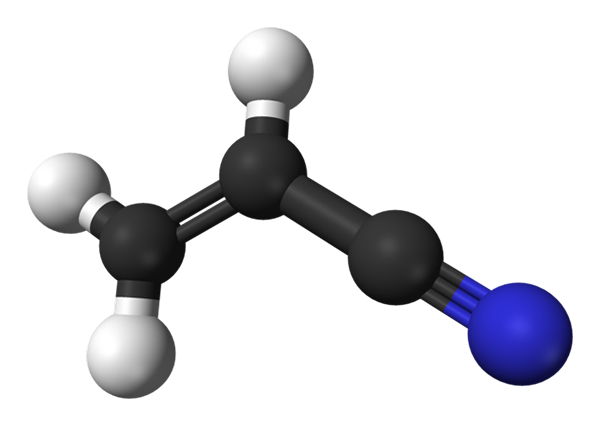 Molekularna struktura akrilonitrila. Vir: Benjah-BMM27 / javna domena
Molekularna struktura akrilonitrila. Vir: Benjah-BMM27 / javna domena Na zgornji sliki imamo molekulo akrilonitrila, predstavljeno z modelom kroglic in palic. Črne sfere ustrezajo atomom ogljika, medtem ko bele in modre do vodika in dušikovega atoma. Levo, ch2= Ch- ustreza vinilni skupini in desni strani Cyano Group, C≡N.
Celotna molekula je ravna, ker imajo ogljikovi vinilni skupini hibridizacijo2. Medtem ima Ciano Group Carbon hibridizacijo SP, ki je poleg atoma dušika v črti, ki počiva na isti ravnini kot preostala molekula.
Skupina CN prispeva polarnost k molekuli, zato molekula Cho2CHCN vzpostavi trajni dipol, kjer je najvišja elektronska gostota usmerjena proti dušikovemu atomu. Zato dipol-dipol.
Vam lahko služi: kaj je kemična periodičnost?Molekule pogl2CHCN so ravni, saj lahko pričakujejo, da so v svojih kristalih (utrjenih pri -84 ° C) na voljo drug na drugem, kot so listi ali listi papirja, tako da se njihovi dipoli ne odbijajo.
Lastnosti
Fizični videz
Brezbarvna tekočina, vendar z rumenkastimi toni, ko predstavlja nekatere nečistoče. Ko je tako, priporočajo, da ga destilirajo pred njegovo uporabo. Je nestanoviten in ima tudi intenziven vonj, podoben čebuli.
Molarna masa
53.064 g/mol
Tališče
-84 ° C
Vrelišče
77 ° C
Plamenišče
-5 ° C (zaprta skodelica)
0 ° C (odprta skodelica)
Temperatura samostojnosti
481 ° C
Gostota
0,81 g/cm3
Gostota hlapov
1,83 v zračnem razmerju.
Parni tlak
109 mmHg pri 25 ° C
Topnost
V vodi ima topnost 74 g/L do 25 ° C. Acrilonitril je znatno topen tudi v acetonu, olju, etanolu, etil acetatu in benzenu.
Razgradnja
Ko toplotno sprošča strupeni vodikov cianid, ogljikove okside in dušikove okside.
Proizvodnja
Sohio postopek
Akrionitril se lahko pojavi na masivnih lestvicah s številnimi reakcijami in kemičnimi procesi. Od vseh je postopek Sohio najbolj uporabljen, ki ga sestavlja katalitična amaksidacija propilena. V reaktorju s fluidiziranim ležiščem se propilen pomeša z zrakom in amonijakom pri temperaturi okoli 400 in 510 ° C, kjer reagirajo na trdne katalizatorje.
Reaktanti enkrat vstopijo v reaktor in potekajo naslednjo reakcijo:
2ch3−ch = ch2 + 2 NH3 + 3 o2 → 2 pog2= Ch-c≡n + 6 h2Tudi
Upoštevajte, da se kisik zmanjša na vodo, medtem ko propilen oksidira atrilonitril. Od tod tudi ime „amoksidacija“, ker gre za oksidacijo, ki vključuje sodelovanje amoniaka.
Vam lahko služi: vrelo: koncept, vrste in primeriAlternativni procesi
Poleg postopka Sohio je mogoče omeniti tudi druge reakcije, ki omogočajo pridobivanje akrilonitrila. Očitno niso vsi razširljivi ali vsaj na zadosten donosen način, niti ne ustvarjajo izdelkov z visoko zmogljivostjo ali čistostjo.
Akrilonitril je sintetiziran, spet iz propilena, vendar se na katalizatorjih PBO reagira z dušikovim oksidom2-Zro2 Airgel -Saped. Reakcija je naslednja:
4 pogl3−ch = ch2 + 6 Ne → 4 CHO2= Ch-c≡n + 6 h2Ali + n2
Reakcija, ki ne vključuje propilena, je tista, ki se začne z etilen oksidom, ki reagira z vodikovim cianidom, da se pretvori v etilen cianohidrin; In pozneje postane dehidriran pri temperaturi 200 ° C v akrilonitrilu:
Eto + hcn → ch2Oh2Cn
Pogl2Oh2CN + Q (200 ° C) → ch2= Ch-c≡n +h2Tudi
Druga veliko bolj neposredna reakcija je dodajanje vodikovega cianida na acetilenu:
HC≡CH + HCN → CH2= Ch-cdajon
Vendar se oblikuje veliko sekundarnih izdelkov, zato je kakovost akrilonitrila nižja v primerjavi s postopkom Sohio.
Poleg zgoraj omenjenih snovi, Lactonitrile, propionitril.
Prijave
 Legos se v glavnem izdelujejo s plastiko ABS, kopolimer, v katerem je del akrilonitrila. Vir: pxhere.
Legos se v glavnem izdelujejo s plastiko ABS, kopolimer, v katerem je del akrilonitrila. Vir: pxhere. Acrilonitrile je nepogrešljiva snov za industrijo plastike. Več njegovih pridobljenih plastike je zelo znanih. Takšni je primer kopolimerov akrilonitrilo-butadiena-stirena (ABS), s katerimi se proizvajajo kosi laikov. Imamo tudi akrilna vlakna, ki so bila razdelkana s homopolimerom poliakrilonitrila (PAN).
Vam lahko služi: saponifikacijaMed drugimi plastiko, ki vsebuje akrilonitril kot monomer ali ki so odvisni od nje za njegovo izdelavo, imamo: akrilenski razteg (SAN), butadienski akrilonitril (NBR), akrilonitril razteg.
Praktično lahko vsak naravni polimer, kot je bombaž. Tako dobimo nitrilne derivate, zaradi česar je kemija zelo širokega akrilonitrila.
Ena od njenih uporabe zunaj sveta plastike je kot pesticid, pomešan z ogljikovim tetrakloridom. Vendar pa so zaradi strašnega vpliva na morski ekosistem takšni pesticidi prepovedali ali so podvrženi močnim omejitvam.
Tveganja
Acrilonitrile je nevarna snov, zato je treba z njo manipulirati z izjemno skrbnostjo. Vsaka neprimerna ali pretirano dolgotrajna izpostavljenost tej spojini je lahko smrtonosna, bodisi z vdihavanjem, vnosom ali fizičnim stikom.
Ohraniti ga je treba, kolikor je mogoče iz katerega koli toplotnega vira, saj je nestanovitna in zelo vnetljiva tekočina. Prav tako ne bi smel biti v stiku z vodo, ker z njo silovito reagira.
Poleg tega je morda rakotvorna snov, ki je povezana z raki jeter in pljuč. Tisti, ki so bili izpostavljeni tej snovi.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). Akrilonitril. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Akrilonitril. Baza podatkov Pubchem., Cid = 7855. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Elsevier b.V. (2020). Akrilonitril. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Korry Barnes. (2020). Kaj je akrilonitril? - Uporaba in lastnosti. Študij. Okrevano od: študij.com
- Pajonk, g.M., Manzalji, t. (1993). Sinteza akrilonitrila iz mešanic propilen in dušikovega oksida na PBO2-Zro2 Airgel katalizatorji. Catal Lett enaindvajset, 361-369. doi.org/10.1007/BF00769488
- « Dinamične značilnosti programiranja, primer, prednosti, slabosti
- Kaj je izotermalni postopek? (Primeri, vaje) »

