Kaj je izotermalni postopek? (Primeri, vaje)

- 1377
- 57
- Don Nitzsche
On izotermalni postopek ali izoterm je reverzibilen termodinamični postopek, pri katerem temperatura ostane konstantna. V plinu obstajajo situacije, v katerih sprememba sistema ne povzroča variacij temperature, ampak v fizikalnih značilnostih.
Te spremembe so fazne spremembe, ko se snov spremeni iz trdne v tekočino, plinske tekočine ali obratno. V takih primerih molekule snovi prilagodijo svoj položaj in dodajajo ali pridobivajo toplotno energijo.
 Slika 1. Karambani, ki se stopijo, so primer izotermalnega procesa. Vir: Pixabay.
Slika 1. Karambani, ki se stopijo, so primer izotermalnega procesa. Vir: Pixabay. Toplotna energija, potrebna za spremembo faze, se v snovi imenuje latentna toplota ali transformacijska toplota.
Eden od načinov za pridobitev izotermalnega postopka je, da se obrnete na snov, ki bo v študijskem sistemu z zunanjim toplotnim nahajališču, ki je še en velik sistem kalorične zmogljivosti. Na ta način pride do take počasne izmenjave toplote, da temperatura ostane konstantna.
Te vrste procesov so pogosto dani v naravi. Na primer, pri ljudeh, ko se telesna temperatura poveča ali spusti, se počutimo slabo, saj v našem telesu številne kemijske reakcije, ki vzdržujejo življenje, dajejo pri konstantni temperaturi. To velja za vročo kri na splošno.
Drugi primeri so led, ki se topi z vročino, ko pridejo pomladi in ledene kocke.
[TOC]
Primeri izotermalnih procesov
-Presnova vroče krvi živali se izvaja pri konstantni temperaturi.
 Slika 2. Vroče krvave živali imajo mehanizme, s katerimi ohranjajo konstantno temperaturo. Vir: Wikimedia Commons.
Slika 2. Vroče krvave živali imajo mehanizme, s katerimi ohranjajo konstantno temperaturo. Vir: Wikimedia Commons. -Ko voda vre fazna sprememba, plinske tekočine in temperatura ostane konstantna pri približno 100 ° C, saj lahko drugi dejavniki vplivajo na vrednost.
-Led, ki se topi, je še en pogost izotermalni postopek, pa tudi postavljanje vode v zamrzovalnik za izdelavo kock ledu.
Vam lahko služi: geometrijska optika: katere študije, zakoni, aplikacije, vaje-Avtomobilski motorji, hladilniki in številne druge vrste strojev pravilno delujejo v določenem temperaturnem območju. Za ohranitev ustrezne temperature se imenujejo naprave Termostati. V svoji zasnovi se uporabljajo različna načela delovanja.
Carnotov cikel
Carnotov motor je idealen stroj, iz katerega se dela pridobiva zaradi povsem reverzibilnih procesov. To je idealen stroj, ker ne upošteva procesov, ki razpršijo energijo, kot viskoznost snovi, ki opravlja delo, niti trenja.
Carnotov cikel je sestavljen iz štirih stopenj, od katerih sta dve natančno izotermalni, drugi pa dve adiabatiki. Izotermalne stopnje so stiskanje in širitev plina, ki je odgovoren za izdelavo koristnega dela.
Avtomobilski motor deluje s podobnimi načeli. Gibanje bata znotraj valja se prenaša na druge dele avtomobila in povzroči gibanje. Nima vedenja idealnega sistema, kot je Carnotov motor, vendar so termodinamična načela pogosta.
Izračun dela, opravljenega v izotermalnem procesu
Za izračun dela, ki ga opravlja sistem, kadar je temperatura konstantna, je treba uporabiti prvi zakon termodinamike, ki navaja:
ΔU = Q - W
To je še en način izražanja ohranjanja energije v sistemu, predstavljeno skozi ΔU ali sprememba energije, Q kot toplota in končno W, kar je delo, ki ga opravlja omenjeni sistem.
Recimo, da je zadevni sistem idealen plin, ki ga vsebuje valj bata mobilnega območja Do, Kaj deluje, ko je njegova glasnost V sprememba V1 do V2.
 Slika 3. V izotermalnem procesu se plin razširi v batu, ne da bi spremenil temperaturo. Vir: YouTube.
Slika 3. V izotermalnem procesu se plin razširi v batu, ne da bi spremenil temperaturo. Vir: YouTube. Idealna enačba statusa plina je Pv = nrt, ki povezuje prostornino na tlak Str in temperaturo T. Vrednosti n in r so konstantne: n je število molov plina in r konstanta plina. V primeru izotermalnega procesa izdelek Pv To je konstantno.
Lahko vam služi: Antoine Constants: Formule, enačbe, primeriNo, opravljeno delo se izračuna z vključitvijo majhnega diferencialnega dela, v katerem sila F Proizvaja majhen premik DX:
Dw = fdx = padx
Kot Adx je ravno variacija glasnosti DV, tako:
Dw = pdv
Za pridobitev skupnega dela v izotermalnem procesu je izraz DW integriran:
Pritisk Str in glasnost V So grafi na diagramu P-V Kot je prikazano na sliki in opravljenem delu, je enakovredno območju pod krivuljo:
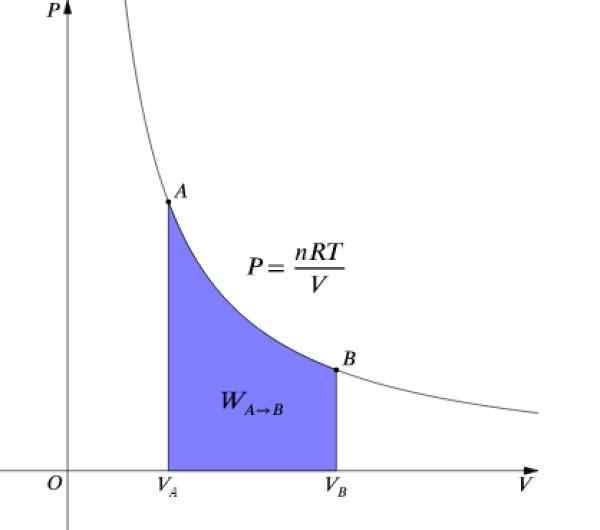 Slika 4. P-V diagram izotermalnega procesa. Vir: Wikimedia Commons.
Slika 4. P-V diagram izotermalnega procesa. Vir: Wikimedia Commons. Kot ΔU = 0 Ker temperatura ostane konstantna, mora v izotermalnem procesu:
Q = w
- Vaja 1
Valj z mobilnim batom vsebuje idealen plin pri 127 ° C. Če se bat premakne, dokler se začetna prostornina 10 -krat zmanjša, tako da ohranja temperaturno konstantno, poiščite količino molov, ki jih vsebuje valj, če je delo na plin 38.180 J.
Dejstvo: R = 8.3 J/mol. K
Rešitev
Izjava potrjuje, da temperatura ostane konstantna, potem smo v prisotnosti izotermalnega procesa. Za delo na plin, ki ga prej odštejete enačbo:

127 º C = 127 + 273 K = 400 K
N jasno, število molov:
N = w / rt ln (v2 / v1) = -38180 j / 8.3 J/mol.K x 400 k x ln (v2/10V2) = 5 molov
Negativni znak je bil pred delom. Pozorni bralec bo v prejšnjem razdelku opazil, da je bil W opredeljen kot "delo, ki ga je opravljal sistem" in ima znak +. Torej ima "delo, opravljeno v sistemu" negativen znak.
Lahko vam služi: drugo ravnotežno stanje: razlaga, primeri, vaje- Vaja 2
Imate zrak v jeklenki, ki je opremljen z batom. Sprva jih je 0.4 m3 tlaka pri temperaturi 100 kPa in 80 ° C. Zrak je stisnjen na 0.1 m3 poskrbite, da temperatura znotraj valja med postopkom ostane konstantna.
Določite, koliko dela je opravljeno med tem postopkom.
Rešitev
Uporabljamo enačbo za prej odšteto delo, vendar je število molov neznano, kar je mogoče izračunati z enačbo idealnih plinov:
80 ° C = 80 + 273 K = 353 K.
Str1V1 = n.R.T → N = P1V1 /Rt = 100000 Pa x 0.4 m3 /8.3 J/mol. K x 353 k = 13.65 mol
W = n.R.T ln (v2/V1) = 13.65 mol x 8.3 J/mol. K x 353 k x ln (0.1/0.4) = -55.442.26 J
Spet negativni znak kaže, da je bilo delo opravljeno v sistemu, kar se vedno zgodi, ko se plin stisne.
Reference
- Bauer, w. 2011. Fizika za inženiring in znanosti. Zvezek 1. MC Graw Hill.
- Cengel in. 2012. Termodinamika. 7ma Izdaja. McGraw Hill.
- Figueroa, d. (2005). Serija: Fizika za znanost in inženiring. Zvezek 4. Tekočine in termodinamika. Uredil Douglas Figueroa (USB).
- Vitez, r. 2017. Fizika za znanstvenike in inženiring: strateški pristop.
- Serway, r., Vulle, c. 2011. Osnove fizike. 9na Cengage učenje.
- Wikipedija. Izotermalni postopek. Pridobljeno iz: v.Wikipedija.org.


