Struktura titanov oksida (iv), lastnosti, uporabe

- 1195
- 284
- Lee Farrell
On Titanov oksid (iv) To je kristalno bela anorganska trdna snov, katere kemična formula je stric2, Tako je znan tudi kot titanov dioksid. Obstaja v treh kristalnih oblikah: Rutilo, Anatasa in Brookita. Čeprav je v naravi običajno obarvan zaradi prisotnosti nečistoč, kot so železo, krom ali vanadij, stric2 Čista se uporablja kot beli pigment.
Med njenimi značilnostmi lahko poudarimo, da topnost strica2 Precej je odvisno od njegove kemijske in toplotne zgodovine. Poleg tega, da ko se segreje na visoke temperature (900 ° C), postane kemično inerten. Njeni najpomembnejši viri so ilmenit (železo in titanov oksid), rutilo in anataza.
 Prah titanov dioksida. Prvotni nalagalnik je bil Walkerma v angleški Wikipediji. [Javna domena]
Prah titanov dioksida. Prvotni nalagalnik je bil Walkerma v angleški Wikipediji. [Javna domena] Pojavi se predvsem v ustrezni meri za uporabo kot pigment, kar zagotavlja njegove odlične lastnosti disperzije v aplikacijah, ki zahtevajo belo motnost in svetlost.
Pojavlja se tudi kot ultrafini material, za uporabo, v katerih je potrebna preglednost in največja absorpcija ultravijoličnih žarkov (UV). Na primer kot sestavni del krem za kožo. V teh stric2 Deluje kot filter in tako blokira absorpcijo teh žarkov.
Zaradi kemijske vztrajnosti je najprimernejši beli pigment. Vendar pa ameriška uprava za hrano in zdravila ali FDA (kratica za angleščino Ali.S. Uprava za hrano in zdravila), je vzpostavil parametre za varno uporabo v hrani in kozmetiki.
Obstaja tudi meja izpostavljenosti prahu iz titanovega oksida, saj se ob vdihavanju prahu lahko odloži v pljuča.
Lahko vam služi: kalkogeni ali amfumos[TOC]
Struktura
Stric2 Ima tri kristalne spremembe: Rutilo, Anatasa in Brookita. Te kristalne sorte so v naravi.
Rutilo
Rutho kristalizira v tetragonalnem sistemu z dvema enotama Tio2 za vsako celico. Titanium je koordiniran oktaconokono. Kalorimetrične študije so pokazale, da je Rutilo najbolj stabilna kristalna oblika.
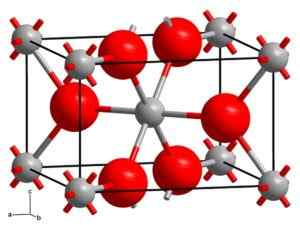 Kristalna struktura rutila. Sive kroglice: titanin, roza kroglice: kisik. Trdno stanje [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Vir: Wikipedia Commons
Kristalna struktura rutila. Sive kroglice: titanin, roza kroglice: kisik. Trdno stanje [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Vir: Wikipedia Commons Anatasa
Ta oblika kristalizira v tetragonalnem sistemu, vendar je anataza predstavljena v obliki zelo popačenih oktomov kisikovih atomov glede na vsak atom titana, dva pa sta relativno najbližja. Ima 4 enote strica2 Za vsako kristalno celico.
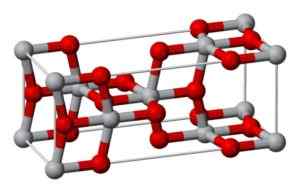 Kristalna struktura anataze. Benjah-BMM27 [javna domena] Vir: Wikipedia Commons
Kristalna struktura anataze. Benjah-BMM27 [javna domena] Vir: Wikipedia Commons Brookita
Kristalizira v ortorrombičnem sistemu z 8 enotami TiO2 Za vsako kristalno celico.
Lastnosti
Fizično stanje
Kristalna trdna.
Mohs trdota
Rutilo: 7-7.5.
Anatasa: 5,5–6.
Molekularna teža
79,87 g/mol.
Tališče
Rutilo: 1830-1850 ° C.
Anatasa: Ko segrevanje postane rutilo.
Gostota
Rutilo: 4.250 g/cm3
Anatasa: 4.133 g/cm3
Brookita: 3.895 g/cm3
Topnost
Netopna v vodnih in organskih topilih. V Hf in h se počasi raztopi2SW4 Vroč koncentrat. Netopna v hcl in hno3.
ph
7.5.
Lomni količnik
Rutilo: 2,75 do 550 nm.
Anatasa: 2,54 do 550 nm.
Ima najvišji indeks loma vseh anorganskih pigmentov.
Druge lastnosti
Anataza se hitro pretvori v rutilo pri temperaturah nad 700 ° C. Stric2 ki je bil kalciniran pri 900 ° C, se v bazah šibko raztopi, fluorhorhorical kislina in vroče žveplove kisline. Ne napadejo ga šibke anorganske kisline ali organske kisline. Ni enostavno zmanjšati ali oksidirati.
Lahko vam služi: Scandio: Zgodovina, lastnosti, reakcije, tveganja in uporabeAnataza in rutil.
Nomenklatura
-Titanov dioksid
-Rutilo
-Anatasa
-Brookita
-Titania
Prijave
Beli pigmenti
Najpomembnejša uporaba titanovega oksida (IV) je kot beli pigment v najrazličnejših izdelkih, ki vključujejo barve, lake, lepila, plastika, papir in črnila. To je posledica visokega indeksa loma in kemične inercije.
 Vir: Pexels.com
Vir: Pexels.com Titanov dioksid, ki se uporablja kot beli pigment, mora imeti visoko čistost. Njegova motnost in svetlost izhajata iz njegove sposobnosti razprševanja svetlobe. Je svetlejši od diamanta. Samo rutilo in anataza imata dobre pigmentacijske lastnosti.
Plastika
V plastiki stric2 Zmanjša krhkost in razpok, ki se lahko pojavijo kot posledica izpostavljenosti svetlobi.
Je najpomembnejši pigment pri izdelavi zunanjih PVC plastičnih predmetov, ker materialu zagotavlja zaščito UV.
Optimalna kristalna oblika v tem primeru je rutilo. V tej aplikaciji mora imeti rutilo površinsko prevleko cirkonija, silicijevega dioksida, da se čim bolj zmanjša fotokatalitični učinek strica2 Pri razgradnji PVC.
Druge uporabe
Druge uporabe vključujejo steklovine, ki se uporabljajo v staljenem jeklu in železu, ki daje motnost in odpornost na kislino.
V tekstilni industriji se uporablja v navodilih za nit, tako da med prejo zlahka drsijo. Trenje med nitmi in vodniki ustvarja statično elektriko. Da ga razblini, stric2 Zažgati ga je treba pri 1300 ° C, da bi imel večjo električno prevodnost.
Vam lahko služi: litijev fluorid: struktura, lastnosti, pridobivanje, uporabeDruge aplikacije vključujejo pigmentacijo črnila za tisk. Kot papirnat prevleka, stric2 Zaradi tega je bel, svetlo in bolj neprozorno.
Uporablja se v kozmetiki za pokrivanje nepopolnosti kože, pa tudi za dajanje bele zobne paste in mila.
Omogoča zaščito hrane, pijač, dodatkov in farmacevtskih izdelkov pred prezgodnjo degradacijo, ki jo prinaša učinek svetlobe, podaljša življenjsko dobo izdelka.
Je komponenta pri proizvodnji stekla, keramike in elektrokeramike. Uporablja se v elementih električnega vezja. Uporablja se tudi v senzorju kisika izpušnih sistemov motornih vozil.
Stric2 Ultrafino se uporablja kot sestavni del blokatorjev sonca, saj je močan vpojnik ultravijoličnih žarkov (UV), UV-A in UV-B. UV-A žarki povzročajo gube in staranje kože, UV-B pa povzročijo opekline in eritem.
Nanodelci stric2 Uporabljajo se kot material za podporni material za kemične reakcije.
Anataza je fotokatiranje učinkovito, ki oksidira organske spojine. Medtem ko so mladoletniki njegovi delci, je učinkovitejši.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. John Wiley & Sons.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Zvezek 19 in 24. Četrta izdaja. John Wiley & Sons.
- Dejstva o kemični varnosti. (2019). Titanov dioksid. Okrevano od: ChemicalSafetyFacts.org
- Wypych, George. (2015). PVC dodatki. V PVC formulah (druga izdaja). Okrevano od Scientirect.com
- Denning, r. (2009). Izboljšanje volnenih izdelkov z uporabo nanotehnologije. V napredku v tehnologiji volne. Okrevano od Scientirect.com
- Nacionalna knjižnica medicine. (2019). Titanov dioksid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- « Funkcija hormonov ščitničnega profila, pomembnost, kvantifikacija
- Značilnosti in legenda chulachaqui »

