Vrste baterij, lastnosti in reakcij

- 3507
- 765
- Dexter Koch
Na trgu se lahko razlikujete Vrste baterij z njene karakteristike lastnik. A.
Na splošno je mogoče baterije kupiti izolirane; Vendar so tudi serijsko ali vzporedno pritrjene drug na drugega, katere komplet je tisto, kar imenujejo baterije. In tako se včasih neselektivno uporabljajo izrazi "baterije" in "baterije", tudi če niso enaki.
 Alkalne baterije: ena najbolj znanih vrst baterij
Alkalne baterije: ena najbolj znanih vrst baterij Baterije imajo lahko nešteto barv, oblik in velikosti, kot je mogoče izdelati iz drugih materialov. In še pomembneje, njihova notranja struktura, kjer se razvijajo kemične reakcije, ki proizvajajo elektriko.
Na primer, tri alkalne baterije, eno najpogostejših so prikazane na zgornji sliki. Izraz alkalen se nanaša na dejstvo, da je medij, kjer se pojavlja sproščanje in pretok elektronov, osnovni; to pomeni, da ima pH večji od 7 in prevladujejo anioni OH- in druge negativne stroške.
[TOC]
Klasifikacija PILAS
Preden se lotite nekaterih različnih vrst baterij, je treba vedeti, da so te globalno razvrščene kot primarni ali sekundarni.
- Primarne baterije
Primarne baterije so tiste, ki jih enkrat porabimo, zavržemo ali recikliran, saj je kemična reakcija, na kateri je vzdržen električni tok, nepopravljiva. Zato jih ni mogoče napolniti.
Uporabljajo se predvsem v aplikacijah, kjer je za polnjenje električne energije nepraktično; na primer na vojaških napravah, sredi bojišča. Zasnovani so tudi za opremo, ki porabi malo energije, tako da trajajo dlje; Na primer daljinske kontrole ali prenosne konzole (Gameboy, Tetris in Tamagotchi).
Alkalne baterije, če navajajo še en primer, pripadajo tudi primarni vrsti. Običajno imajo valjaste oblike, čeprav to ne pomeni, da cilindrične baterije ne morejo biti sekundarne ali polnilne.
- Sekundarne baterije
Za razliko od primarnih baterij lahko sekundarne napolnite, ko jim zmanjka energije.
To je zato, ker so kemične reakcije, ki se pojavijo znotraj njih.
Nekatere sekundarne baterije (imenovane baterije) so običajno majhne, prav tako primarne; Vendar so dodeljeni naprave, ki porabijo več energije in za katere bi bila uporaba primarnih baterij ekonomsko in energično. Na primer, baterije mobilnih telefonov vsebujejo sekundarne baterije.
Tudi sekundarne baterije so zasnovane za veliko opremo ali vezje; Na primer avtomobilske baterije, ki so sestavljene iz več baterij ali voltaičnih celic.
Običajno so dražje od primarnih baterij in baterij, vendar za dolgoročne uporabe na koncu ustrezneje in učinkovitejše možnosti.
- Drugi vidiki
Baterije so razvrščene bodisi v primarnem ali sekundarnem; Toda komercialno ali popularno so običajno razvrščeni po obliki (cilindrični, pravokotni, gumbi), na napravo, ki je bila namenjena (kamere, vozila, kalkulatorji), na svoja imena (AA, AAA, C, D, N, A23 itd. .), In do kode IEC in ANSI.
Lahko vam služi: piridin: struktura, lastnosti, uporabe, strupenost, sintezaTudi značilnosti, kot so njegova napetost (1,2 do 12 voltov), ter njihovo koristno življenje in cene, so odgovorne za podelitev določene klasifikacije v potrošnikovih očeh.
Seznam tipov
- Baterije iz karbona-cinc
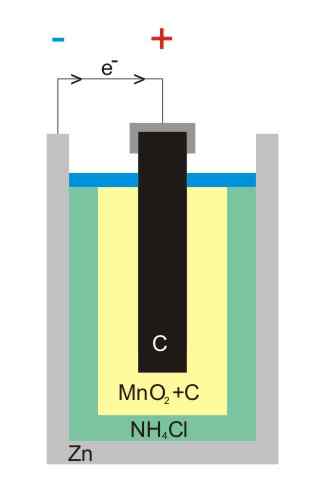 Ilustracija baterije z cinkovim ogljikom
Ilustracija baterije z cinkovim ogljikom Baterije iz karbona-cinc (znane tudi kot celice Leclanché ali Salinas Pilas) so ena najbolj primitivnih in se trenutno štejejo za skoraj zlorabljene pred drugimi baterijami; Predvsem pred alkalnimi baterijami, ki so čeprav so nekoliko dražje, imajo življenjsko dobo in večje napetosti.
Kot že ime pove, so njegove elektrode sestavljene iz pločevinke cinka in grafitne palice, ki ustreza anodi oziroma katodi.
V prvi elektrodi anoda izvira iz elektronov z oksidacijo kovinskega cinka. Ti elektroni nato potujejo z zunanjim vezjem, ki napaja napravo z elektriko, nato pa končajo v grafitni katodi, kjer se cikel zaključi, ko se manganov dioksid zmanjša, v katerem je potopljen.
Reakcije
Kemične enačbe za reakcije, ki se pojavljajo v elektrodah, so:
Zn (S) → Zn2+(AC) + 2E- (Anoda)
2 Mno2(s) + 2e- + 2 NH4Cl (ac) → mn2Tudi3(s) + 2 NH3(Ac) + h2Ali (l) + 2 Cl- (AC) (katoda)
Te baterije so zelo podobne alkalnim: obe sta cilindrični (na primer slike). Vendar pa lahko baterije z ogljikovim cinkom ločite, če so značilnosti, označene v tujini. Njegova napetost je 1,5 V.
- Alkalne baterije
Alkalne baterije so zelo podobne tistim iz vrste ogljika-cinka, z razliko, da medij, kjer elektrode vsebujejo anione OH-. Ta medij je sestavljen iz močnih elektrolitov kalijevega hidroksida, KOH, ki prispeva- ki sodelujejo in "sodelujejo" pri migraciji elektronov.
Na voljo je v različnih velikostih in napetostih, čeprav je najpogostejša 1,5 V. So morda najbolj znane baterije na trgu (na primer Duracell).
Reakcije, ki se pojavljajo v njihovih elektrodah, so:
Zn (s) + 2OH-(aq) → ZnO (S) + H2Ali (l) + 2e- (Anoda)
2mn2(s) + h2Ali (l) + 2e- → Mn2Tudi3(s) + 2OH-(aq) (katoda)
Ko se temperatura zvišuje, se reakcije pojavijo hitreje in hitreje se baterije odvajajo. Zanimivo je, da so bile priljubljene govorice, da bi jih postavili v zamrzovalnik, da bi povečali čas življenja; Toda pri ohlajanju lahko njegova vsebina utrpi morebitne trditve, ki prinašajo nadaljnje pomanjkljivosti ali tveganja z njimi.
Živo srebro
 Verjetna baterija živega srebra, ki jo je mogoče zamenjati z baterijo srebrnega oksida. Vir: Multicherry [CC0].
Verjetna baterija živega srebra, ki jo je mogoče zamenjati z baterijo srebrnega oksida. Vir: Multicherry [CC0]. Merkurske baterije so zelo značilne zaradi svojevrstne sramote srebrnih gumbov (vrhunska slika). Skoraj vsi bi jih prepoznali na prvi pogled. Prav tako so alkalne, vendar njihova katoda poleg grafita in manganovega dioksida, živega oksida, HGO, vključuje tudi grafit in manganov dioksid; ki po zmanjšanju postane kovinsko živo srebro:
Zn (s) + 2OH-(AC) → ZnO (S) + H2Ali (l) + 2e-
HgO (s) + h2O + 2e- → hg (s) + 2oh-
Vam lahko služi: magnezijev oksid: struktura, lastnosti, nomenklatura, uporabljaUpoštevajte, kako se v teh celičnih reakcijah porabijo in regenerirajo-.
Ker je majhne baterije, je namenjeno majhnim artefaktom, kot so ure, kalkulatorji, nadzor igrač itd. Kdo je uporabil katerega koli od teh predmetov, bo opazil, da ni treba spremeniti baterij za skoraj "večnost"; ki bi bil star 10 let, približno.
Srebrni oksid
 Baterije srebrnega oksida. Vir: Lukas A, CZE [javna domena].
Baterije srebrnega oksida. Vir: Lukas A, CZE [javna domena]. Glavna napaka baterij živega srebra je, da ko jih zavržejo, predstavljajo resno težavo za okolje, zaradi strupenih značilnosti omenjene kovine. Mogoče to primanjkuje kode IEC in ANSI manjka. Za baterije srebrnega oksida je pred njeno kodo IEC črko S.
Eden od nadomestnih baterij živosrevanja ustreza srebrni oksidu, veliko dražje, vendar manj ekološkega vpliva (vrhunska slika). V svojih začetkih so vsebovali živo srebro za zaščito cinka pred alkalno korozijo.
Na voljo je z napetostjo 1,5 V, njegove aplikacije pa so zelo podobne kot pri Mercury Pila. Pravzaprav obe bateriji na prvi pogled izgledata enaka; Čeprav so lahko veliko večje baterije srebrnega oksida.
Reakcije v njihovih elektrodah so:
Zn (s) + 2OH-(AC) → Zn (OH)2(s) + 2 e-
Ag2Ali (s) + 2h+(AC) + 2E- → 2ag (s) + h2Ali (l)
Voda nato trpi elektrolizo, ki se razgradi na H ione+ in oh-.
Upoštevajte, da je namesto živega srebra nastala v kovinski srebrni katodi.
- Nickel-Cadmium Pilas (NICAD)
 NICD baterija. Vir: Landider [CC0].
NICD baterija. Vir: Landider [CC0]. Od tega trenutka veljajo sekundarne baterije ali baterije. Tako kot živo srebro so tudi nikelj-kadmium baterije škodljive za okolje (za favno in zdravje) s strani kadmijevega kovine.
Za njih je značilno ustvarjanje visokih električnih tokov in velikokrat je mogoče napolniti. Pravzaprav je mogoče napolniti 2000 -krat, kar je enako izjemni trajnosti.
Njegove elektrode so sestavljene iz hidroksida nikljevega oksida, otroka (OH), za katodo in kovinskega kadmija za anodo. Kemična podlaga v bistvu ostaja enaka: kadmij (namesto cinka) izgubi elektrone, kadmij nio (OH) pa jih osvoji.
Porečene reakcije so:
Cd (s) + 2OH-(AC) → CD (OH)2(s) + 2e-
2nio (OH) (s) + 2H2Ali (l) + 2e- → 2ni (OH)2(s) + oh-(AC)
Oh anioni-, Spet prihajajo iz koh elektrolita. Nikad baterije na koncu ustvarijo nikelj in kadmijeve kovinske hidrokside.
Uporabljajo se posamično ali povezane v paketih (na primer rumena, vrhunska slika). Nato pridejo v velikih ali majhnih paketih. Malčki najdejo uporabo v igračah; Toda veliki so namenjeni letalskim in električnim vozilom.
- Nikelj-hidro Metallic Pilas (Ni-HM)
 Ni-hm baterije. Vir: Ramsh Ng iz Flickr (https: // www.Flickr.com/fotografije/rameshng/5645036051)
Ni-hm baterije. Vir: Ramsh Ng iz Flickr (https: // www.Flickr.com/fotografije/rameshng/5645036051) Druga dobro znana baterija ali baterija, ki presega Nicadovo v energetskih zmogljivostih, je Ni-HM (nikelj in kovinski hidrid). Na voljo je lahko v valjasti obliki (običajne baterije, vrhunska slika) ali povezan z baterijo.
Kemično predstavljajo skoraj enake značilnosti kot nicad baterije, z glavno razliko, ki temelji na njegovi negativni elektrodi: katoda ni kadmij, ampak intermetalna zlitina redkih zemelj in prehodnih kovin.
Vam lahko služi: rotacijski sušilnik: delovanje, za kaj je, deli, aplikacijeTa zlitina je odgovorna za absorpcijo vodika, ki nastane med obremenitvijo, pri čemer ustvari zapleten kovinski hidrid (od tod tudi črka H v imenu).
Medtem ko Ni-HM baterije zagotavljajo več energije (približno 40% več), so dražje, se nosijo hitreje in jih ni mogoče ponovno naložiti istega številakrat kot nikad baterije; to pomeni, da imajo nižji življenjski čas. Vendar jim primanjkuje pomnilniškega učinka (izguba zmogljivosti baterije, ker niso popolnoma odpuščeni).
Zaradi tega jih ne bi smeli dolgoročno uporabljati v strojih; Čeprav je ta problem poln baterij LSD-NIHM. Prav tako imajo Ni-HM baterije ali baterije zelo stabilne toplotne značilnosti, saj so v širokem razponu temperatur, ne da bi predstavljali tveganje.
Reakcije
Reakcije, ki se pojavljajo v njihovih elektrodah, so:
Ni (oh)2(s)+ oh-(ac) ⇌ nio (OH) (s) + h2Ali (l) + e-
H2Ali (l) + m (s) + e- ⇌ Oh-(AC)+ MH (S)
- Ionsko-litio baterije
 Litij-ionska baterija prenosnika. Vir: Kristoferb iz Wikipedije.
Litij-ionska baterija prenosnika. Vir: Kristoferb iz Wikipedije. V baterijah in litijevih baterijah temeljijo na selitvi ionov Li+, ki se prenašajo iz anode v katodo, produkt elektrostatičnih odbojnosti z naraščajočim pozitivnim nabojem.
Nekateri se lahko napolnijo, kot so prenosne baterije (vrhunska slika), in drugi, valjasti in pravokotni (gladki2, Lizocl2 ali limuzino2) Ne.
Za ionsko-litijske baterije je značilno, da so zelo lahka in energija, kar omogoča uporabo v številnih elektronskih napravah, kot so pametni telefoni in medicinska oprema. Prav tako trpijo komaj zaradi spominskega učinka, njihova gostota obremenitve presega napake in baterij in baterij NICAD in Ni-HM ter več odlašanja pri prenosu.
Vendar so zelo občutljivi na visoke temperature, celo eksplodirajo; Poleg tega so ponavadi dražje pred drugimi baterijami. Kljub temu so na trgu litijeve baterije vidne z dobrimi očmi in mnogi potrošniki jih lahko kvalificirajo kot najboljše.
- Kisline svinčene baterije
 Tipična baterija avtomobila CARF. Vir: TNTFLASH [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Tipična baterija avtomobila CARF. Vir: TNTFLASH [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] In končno, kislinske bakterije, kot že ime pove, ne vsebuje OH ionov- ampak h+; konkretno koncentrirana raztopina žveplove kisline. Voltaične celice so znotraj svojih škatel (zgornja slika), kjer jih je mogoče zaporedno povezati tri ali šest, kar daje baterijo 6 oziroma 12 V.
Lahko ustvari velike količine električnega naboja, in ker so zelo težke, so namenjene aplikacijam ali napravam, ki jih ni mogoče ročno prevažati; Na primer avtomobili, sončne plošče in podmornice. Ta kislinska baterija je najstarejša in še vedno velja v avtomobilski industriji.
Vaše elektrode so narejene iz svinca: PBO2 Za katodo in gobasto kovinsko svinec za anodo. Reakcije, ki se pojavljajo v njih, so:
Pb (s) +hso-4(aq) → pbso4(s) +h+(aq) + 2e-
Pbo2(s) +hso-4(aq) + 3h+(aq) + 2e- → PBSO4(s) + 2h2Ali (l)
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Odunlade Emmanuel. (24. julij 2018). Različne vrste baterij in eprbacije. Vezje prebav. Okrevano od: CircuitDigest.com
- Prba. (s.F.). Vrste baterij. Okreval od: prba.org
- Isidor Buchman. (2019). Kaj je najboljša baterija? Univerza baterije. Pridobljeno iz: base.com
- Podjetja McGraw-Hill. (2007). 12. poglavje: Baterije. [PDF]. Okreval od: Oakton.Edu
- Shapley Patricia. (2012). Skupne vrste baterij. Univerza v Illinoisu. Okreval od: butana.Kem.Uiuc.Edu
- Ekološki odnos. (22. januar 2017). Vrste baterij: popolna vodnik z baterijami in baterijami, ki obstajajo. Pridobljeno iz: Eccological.com
- « Tomás Mejía Biografija, vojaška kariera, streljanje
- Kisli anhidridi, kako nastanejo, aplikacije in primeri »

