Kisli anhidridi, kako nastanejo, aplikacije in primeri

- 4248
- 130
- Adrian Legros
The kisli anhidridi Veljajo za velik pomen med najrazličnejšimi spojinami organskega izvora, ki obstajajo. Te so predstavljene kot molekule, ki imajo dve kisli skupini (organska substituenta, katerih formula je rco-, kjer je r ogljikova veriga) združena z istim atomom kisika.
Obstaja tudi razred kislinskih anhidridov, ki jih običajno najdemo: karboksilni anhidridi, imenovani, ker je začetna kislina karboksilna kislina. Če želite poimenovati te vrste, katerih struktura je simetrična, je treba opraviti le zamenjava izrazov.

Izraz kisline je treba v nomenklaturi svoje prvotne karboksilne kisline zamenjati z izrazom anhidrida, kar pomeni "brez vode", ne da bi spremenili preostanek imena tvorjene molekule. Te spojine se lahko ustvarijo tudi na podlagi ene ali dveh kislinskih skupin iz drugih organskih kislin, kot sta fosfonska kislina ali sulfonska kislina.
Podobno lahko povzročimo kisline anhidride na podlagi anorganske kisline, kot je fosforna kislina. Vendar so njegove fizikalne in kemijske lastnosti, njegove uporabe in druge značilnosti odvisne od opravljene sinteze in strukture anhidrida.
[TOC]
Kako tvorijo kisli anhidridi?
Nekateri kisli anhidridi izvirajo z različnih načinov, bodisi v laboratoriju bodisi v panogi. V industrijski sintezi se kot primer sprejme ocetni anhidrid, ki ga proizvaja predvsem karbonilacijski proces molekule metil acetata.
Drug primer te sinteze je anhidrid maleico, ki nastane z oksidacijo benzenske molekule ali butana.
Lahko vam služi: cinkov hidroksid (Zn (OH) 2)Vendar je v sintezi kislinskih anihidridov v laboratoriju poudarek na dehidraciji ustreznih kislin, kot je proizvodnja etanskega anhidrida, pri katerem se dve molekuli ethaične kisline dehidrira.
Pojavi se lahko tudi intramolekularna dehidracija; Torej znotraj iste molekule kisline z dvema karboksilnima (ali dikarboksilnima) skupinama, če pa se pojavi nasprotno in kislina anhidrid trpi hidrolizo, regeneracija kislin, ki so nastale.
Kisli anhidridi, katerih acilni substituenti so enaki, medtem ko so pri tej vrsti, ki se štejejo za mešane, te molekule so različni.
Vendar se te vrste ustvarjajo tudi, kadar pride do reakcije med kislim halurjem (katere splošna formula je (RCOX)) z molekulo karboksilata (katere splošna formula je r'coooo-)))))))))). [2]
Splošna formula
Splošna formula kislinskih anhidridov je (RC (O))2Ali, kar je bolje opaziti na sliki, postavljeni na začetku tega članka.
Na primer, za ocetni anhidrid (iz ocetne kisline) je splošna formula (ch3Co)2Ali, piše podobno za številne druge podobne kisline anhidride.
Kot je navedeno zgoraj, imajo te spojine skoraj isto ime svojih predhodnih kislin in edino, kar se spremeni, je izraz kislina z anhidridom, saj je treba upoštevati enaka pravila oštevilčenja atomov in substituentov, da se uspeva z njihovo nomenklaturo.
Prijave
Kisli anhidridi imajo veliko funkcij ali aplikacij, odvisno od polja, ki ga preučujemo, saj imajo visoko reaktivnost, so lahko predhodniki ali so del številnih pomembnih reakcij.
Vam lahko služi: pirolizaPrimer tega je industrija, kjer se v velikih količinah proizvaja ocetni anhidrid, ker je najpreprostejša struktura, ki jo je mogoče izolirati. Ta anhidrid se uporablja kot pomemben organski reagent, kot so acetatni estri.
Industrijska uporaba
Po drugi strani je anhidrid Maleico prikazan s ciklično strukturo, ki se uporablja pri proizvodnji pokritosti za industrijsko uporabo in kot predhodnik nekaterih smol s postopkom kopolimeterizacije s molekulami Stretus. Poleg tega ta snov služi kot dienofil, ko se izvede reakcija Diels-Alderja.
Podobno obstajajo spojine, ki imajo v svoji strukturi dve kislinski anhidridni molekuli, kot je etistarboksilni ali dianhidrid Dianhidrid.
Poleg teh obstaja mešani anhidrid, imenovan 3'-fosphoadenosín-5'-fosfosulfat, iz fosforne in žveplove kisline, ki predstavlja najpogostejši koencim v reakcijah prenosa biološkega sulfata.
Primeri kislinskih anhidridov
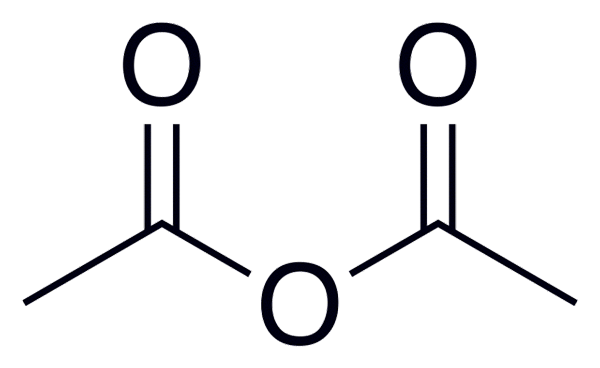 Ocetni anhidrid
Ocetni anhidrid Spodaj je seznam z imeni nekaterih kislinskih anhidridov, da navedete nekaj primerov teh pomembnih spojin v organski kemiji, ki lahko tvorijo spojine linearne strukture ali obroče več članov:
- Ocetni anhidrid.
- Propanoični anhidrid.
- Benzoični anhidrid.
- Maleico anhidrid.
- Sukcinični anhidrid.
- Ftalični anhidrid.
- Naftalente -tracarboxlični dianhidrid.
- Etitertarboksilni dianhidrid.
- Benzokinonteterarboksilni dianhidrid.
Tako kot nastanejo ti anhidridi s kisikom, se dajo tudi druge spojine, kjer lahko atom žvepla nadomesti kisik tako v karbonilni skupini kot v osrednjem kisiku, kot so: na primer:
Vam lahko služi: acetanila (c8h9no)- Tiocetski anhidrid (izberite3C (s)2Da)
Obstaja celo dve molekuli kisline, ki tvorita povezava z istim atomom žvepla; Te spojine se imenujejo Tioanhidridi, namreč:
- Ocetni tioanhidrid ((ch3Co))2S)
Reference
- Wikipedija. (2017). Wikipedija. Pridobljeno iz.Wikipedija.org
- Johnson, a. W. (1999). Povabilo na organsko kemijo. Okrevano iz knjig.Google.co.pojdi.
- Acton, q. Do. (2011). Kisle anhidridne hidrole: napredek v raziskavah in uporabi. Okrevano iz knjig.Google.co.pojdi
- Bruckner, r., In harmata, m. (2010). Organski mehanizmi: reakcije, stereokemija in sinteza. Okrevano iz knjig.Google.co.pojdi
- Kim, j. H., Gibb, h. J., in Iannucci, do. (2009). Anhidridi ciklične kisline: vidiki zdravja ljudi. Okrevano iz knjig.Google.co.pojdi

