Aromatični nukleofilni učinki substitucije, primeri
- 3679
- 728
- Lee Farrell
The Aromatična nukleofilna substitucija (SNAR) je reakcija, ki se pojavlja v organski kemiji, ki je sestavljena iz premika dobre odhodne skupine s strani prihajajočega nukleofila. Z vidika njegovega mehanizma in elektronskih vidikov je nasproten obraz aromatične elektrofilne substitucije (SEAR).
Na splošno je odhajajoča skupina halogen, ki izide kot haluro x anion-. Ta reakcija se lahko zgodi le, če aromatični obroč (večinoma benzen) primanjkuje elektronov; to pomeni, če imate substituentne skupine privlačnih elektronov.
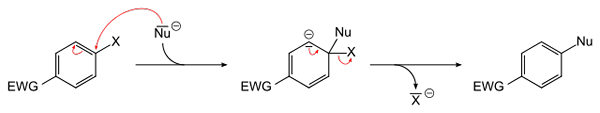
 Splošna enačba za aromatično nukleofilno substitucijo. Vir: Sponk [javna domena]
Splošna enačba za aromatično nukleofilno substitucijo. Vir: Sponk [javna domena] Vrhunska slika shematizira tisto, kar je bilo rečeno v prejšnjem odstavku. Skupina EWG Electron Attractor (za kratico v angleščini: Skupina za umik elektronov), aktivira aromatični obroč za nukleofilni napad negativnih vrst NU-. Vidimo, da nastane posrednik (v središču), iz katerega se sprosti ali sprosti Haluro X-.
Upoštevajte, da ga preprosto x nadomesti NU v aromatičnem obroču. Ta reakcija je zelo vsestranska in potrebna pri sintezi novih zdravil, pa tudi v študijah sintetične organske kemije.
[TOC]
Splošne lastnosti
Aromatični obroč je mogoče "zaračunati" ali "prenesti" iz elektronov, odvisno od tega, kakšni so njihovi substituenti (tisti, ki nadomeščajo prvotno povezavo C-H).
Ko lahko ti nadomestki donirajo elektronsko gostoto obroču, se reče, da jo obogatijo iz elektronov; Če so nasprotno, so privlačniki elektronske gostote (zgoraj omenjena EWG), potem se reče, da osiromašijo elektronski obroč.
V vsakem primeru se obroč aktivira za specifično aromatično reakcijo, medtem ko je deaktiviran za drugo.
Na primer, aromatični obroč, bogat z elektroni, naj bi bil aktiven za aromatično elektrofilno substitucijo; To pomeni, da lahko svoje elektrone podarite elektrofilatnim vrstam in+. Vendar ne bo daroval elektronov NU-, Ker bi se negativne naboje med seboj odbijale.
Vam lahko služi: molekularna orbitalna teorijaZdaj, če je obroč slab v elektroni, nima, kako bi jih dal vrstam in+ (Sear se ne zgodi); Namesto tega je razpoložljivost sprejeti elektrone vrste Nu- (Snar se razvija).
Razlike z aromatično elektrofilno substitucijo
Pojasnili so splošne vidike vstopa, zdaj je mogoče navesti nekatere razlike med SNAR in SEAR:
- Aromatični obroč deluje kot elektrofil (slabi elektroni) in ga napade nukleofil.
- Iz obroča se zamenja odhajajoča skupina X; Ne h+
- Nobene karbokacije se ne oblikujejo, vendar posredniki z negativnim nabojem, ki ga je mogoče preseliti z resonanco
- Prisotnost privlačnejših skupin v obroču pospešuje zamenjavo, namesto da bi jo upočasnila
- Končno te skupine ne izvajajo direktorjev, kje (v katerem ogljiku) se bo zgodila zamenjava. Zamenjava se bo vedno pojavila v ogljiku, povezanem z odhodno skupino X.
Zadnja točka je prikazana tudi na sliki: povezava C-X je pokvarjena, da tvori novo povezavo C-NU.
Učinki
Števila substituentov
Seveda je revnejša v elektroni obroč, hitrejši je poševen in najmanj drastični bodo pogoji, potrebni za to. Razmislite o naslednjem primeru, predstavljenem na spodnji sliki:
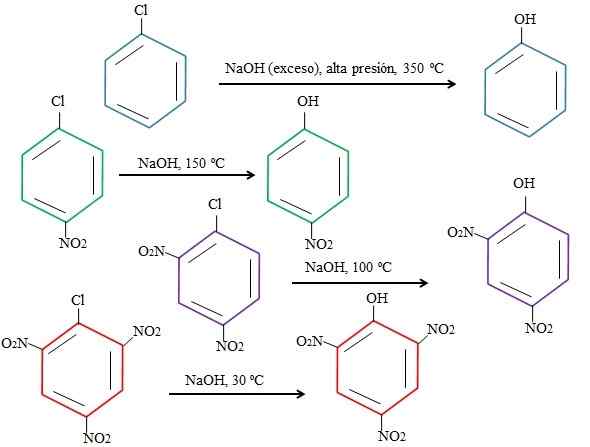 Učinki substituentov na substitucije 4-nitroklorobenzena. Vir: Gabriel Bolívar.
Učinki substituentov na substitucije 4-nitroklorobenzena. Vir: Gabriel Bolívar. Upoštevajte, da 4-nitroklorobenzen (modri obroč) zahteva drastične pogoje (visok tlak in temperatura 350 ° C) do zamenjave CL z. V tem primeru je klor odhajajoča skupina (CL-) in nukleofilni hidroksid (OH-).
Lahko vam služi: 4 obdobja kemije: od prazgodovine do danesKo se skupina ne pojavi2, ki je elektronski privlačnost (zeleni obroč), nadomeščanje se lahko izvede pri temperaturi 150 ° C pri tlaku v okolju. Ko se število skupin poveča2 Prisotna (vijolična in rdeča obroči), zamenjava poteka pri vse bolj nižjih temperaturah (100 ° C oziroma 30 ° C).
Zato skupine ne2 Pospešijo snar in neskladje iz elektronov do obroča, zaradi česar je bolj dovzetna za napad OH-.
Relativni položaji CL tukaj ne bodo razloženi glede na ne2 v 4-nitroklorobenzenu in kako spreminjajo hitrost reakcije; Na primer, reakcijske hitrosti 2-nitroklorobenzena in 3-nitroklorobenzena so drugačne, slednje pa so najpočasnejše v primerjavi z drugimi izomeri.
Od odhajajoče skupine
Če se vrnete k 4-nitroklorobenzenu, je njegova nadomestitvena reakcija počasnejša, če primerjate svojo fluorirano nasprotovanje:
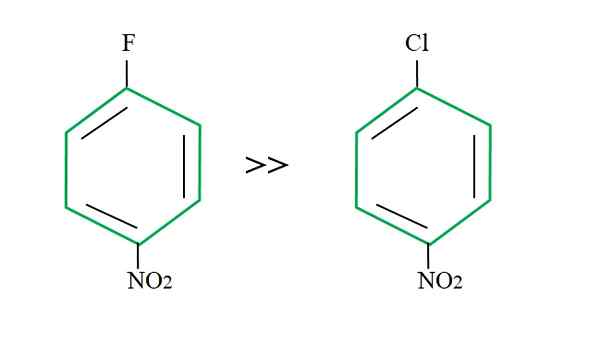 Odhodni skupinski učinek na reakcije SNAR. Vir: Gabriel Bolívar.
Odhodni skupinski učinek na reakcije SNAR. Vir: Gabriel Bolívar. Razlaga tega ne more biti v drugi spremenljivki, da je razlika med F in CL. Fluor je slaba odhodna skupina, saj je povezava C-F težje prebiti kot povezava C-CL. Zato razčlenitev te povezave ni določilni korak hitrosti za snar, ampak dodajanje NU- na aromatični obroč.
Fluor za bolj elektronegativen kot klor, atom ogljika, povezan z njim, ima večje elektronsko pomanjkanje (cδ+-Fδ-). Posledično je ogljik povezave C-F veliko bolj verjetno, da bo napadel NU- kot povezava C-CL. Zato je zamenjava F s OH veliko hitrejša kot pri CL.
Vam lahko služi: bakreni sulfid: struktura, lastnosti, uporabePrimer
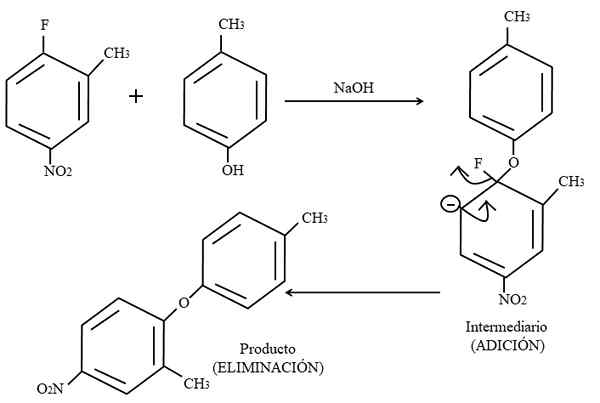 Aromatična elektrofilna zamenjava. Vir: Gabriel Bolívar.
Aromatična elektrofilna zamenjava. Vir: Gabriel Bolívar. Končno je spodaj prikazan primer te vrste organskih reakcij na višji sliki. Para-Coresol ne daje videza nukleofila; Toda z osnovnim medijem je njegova skupina OH nezaščitena, pri čemer pušča fenoksidni anion, ki napade 2-metil-4-nitrofluorzen.
Ko se ta napad zgodi, se pravi, da se nukleofil doda elektrofilu. Ta korak je mogoče videti desno od slike, kjer nastane posredniška spojina z obema substituentma, ki pripadata obroču.
Z dodajanjem para-coresola se pojavi negativna obremenitev, ki v obroču preseli resonanco (opazite, da preneha biti aromatičen).
Na sliki je komaj prikazana najnovejša resonančna struktura, iz katere je fluorid končan kot F-; Toda v resnici ta negativna obremenitev postane disoccupy tudi v atomih kisika v skupini2. Po dodajanju izločitve je zadnji, ki je takrat, ko je izdelek končno oblikovan.
Končni komentar
Skupina št2 Preostali se lahko zmanjšajo na skupino NH2, In od tam je mogoče narediti več sinteznih reakcij za spremembo končne molekule. To prikazuje sintetični potencial SNAR -.
Trenutno pa obstajajo eksperimentalni in računski dokazi, da v resnici reakcija poteka po usklajenem mehanizmu, kjer se oba koraka pojavljata hkrati s pomočjo aktiviranega kompleksa in ne s posrednikom.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Wikipedija. (2019). Nukleofilna aromatična substitucija. Pridobljeno iz: v.Wikipedija.org
- James Ashenhurst. (6. septembra 2019). Nukleofilna aromatična substitucija (NAS). Okrevano od: mastersorganicChemistry.com
- Kemija librettexts. (5. junij 2019). Nukleofilna aromatična substitucija. Okrevano od: kem.Librettexts.org
- « 50 priporočenih blogov za video igre
- Zgodovina cirkonije, lastnosti, struktura, tveganja, uporabe »

