Struktura, funkcija, regulacija, bolezni succinato dehidrogenaze
- 3316
- 948
- Roman Schamberger
SUccinato dehidrogenaza (Sdh), znan tudi kot kompleks II transportne verige elektronov, gre za mitohondrijski beljakovinski kompleks z encimsko aktivnostjo, ki deluje tako v KREBS ciklu kot v verigi elektronov (celično dihanje).
Je encim, ki je prisoten v vseh aerobnih celicah. V evkariotih je kompleks, tesno povezan z notranjo mitohondrijsko membrano, medtem ko ga v prokariotih najdemo v plazemski membrani.
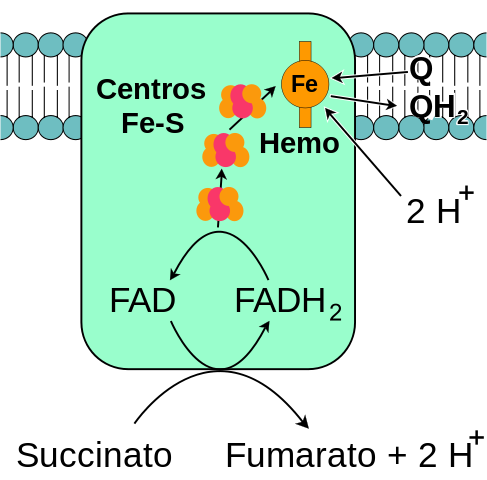 Splošna shema mitohondrijske kompleksa sukcinatne dehidrogenaze (vir: jaz, ki temelji na vektorizaciji fvasconcellos. / Javna domena, prek Wikimedia Commons)
Splošna shema mitohondrijske kompleksa sukcinatne dehidrogenaze (vir: jaz, ki temelji na vektorizaciji fvasconcellos. / Javna domena, prek Wikimedia Commons) Kompleksna sukcinatna dehidrogenaza, ki so jo Singer in Kearney prvič očistili okoli leta 1910 in jo prvič očistili leta 1954, so iz več razlogov obsežno preučevali:
- Deluje tako v KREBS ciklu (cikel citronske kisline ali cikel trikarboksilne kisline) kot v verigi transporta elektronov (katalizira oksidacijo sukcinata v fumarat)
- Njegovo aktivnost urejajo različni aktivatorji in zaviralci in
- To je kompleks, povezan z: železo, ki ni povezano s hemo skupino, labyl žveplom in diukleotidi Flavina Adenina (FAD)
Kodira ga jedrski genom in dokazano je, da mutacije v štirih genih, ki kodificirajo vsako od njegovih podenot (A, B, C in D), povzročajo različne klinične slike, to je, da so lahko od točke precej negativne pogleda na telesno celovitost človeka.
[TOC]
Struktura
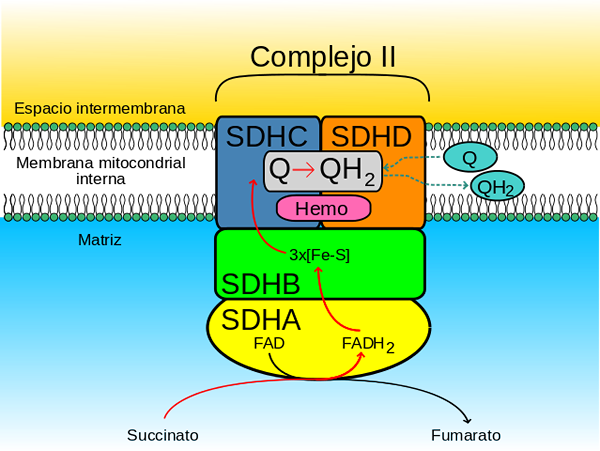
Encimski kompleksni sukcinat dehidrogenazo tvorijo štiri podenote (heterotarámero), ki jih kodira jedrski genom, zato je edini kompleks oksidativne fosforilacije v verigi elektronov, ki nima nobene podenote, ki jo kodira mitohondrični genom.
Poleg tega je ta kompleks edini, ki ne črpa protonov skozi notranjo mitohondrijsko membrano med svojim katalitičnim delovanjem.
Glede na študije, ki temeljijo na encimskem kompleksu prašičevih srčnih celic, kompleksna sukcinatna dehidrogenaza sestavlja:
- A "glava" Hidrofilni ki sega od notranje mitohondrijske membrane do mitohondrijske matrice in
- A "linija" Hidrofobni ki je vpet v notranjo mitohondrijsko membrano in ima majhen segment, ki je projiciran proti topnemu intermembranskemu prostoru mitohondrijev
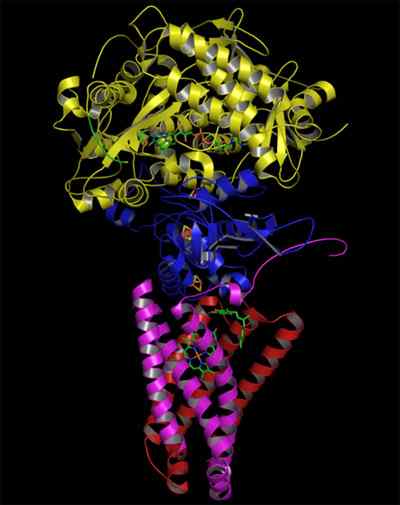
 Struktura kompleksne sukcinatne dehidrogenaze (vir: Zephyris na angleškem jeziku Wikipedia/cc by-sa (http: // creativeCommons.Org/licence/by-sa/3.0/) prek Wikimedia Commons)
Struktura kompleksne sukcinatne dehidrogenaze (vir: Zephyris na angleškem jeziku Wikipedia/cc by-sa (http: // creativeCommons.Org/licence/by-sa/3.0/) prek Wikimedia Commons) Hidrofilna struktura porcije
Hidrofilna glava je sestavljena iz SDHA (70 kDa) in SDHB (27 kDa) (SDH1 in SDH2 v kvasovkah), ki obsega katalitično središče kompleksa.
Podenote SDHA in SDHB vsebujejo redoks kofaktorje, ki sodelujejo pri prenosu elektronov na ubikinon (koencim Q10, molekula, ki prevaža elektrone med respiratornimi kompleksi I, II in III).
Podenota SDHA ima kofaktor FAD (koencim, ki sodeluje v reakcijah oksida-redukcije) skupaj s svojo strukturo, tik na mestu stičišča za sukcinat (glavni substrat encima).
Podenota SDHB ima 3 železno-sugarjeve centre (Fe-S), ki posredujejo prenos elektronov na ubikinon. Eden od središč, 2FE-2s, je blizu mesta FAD podenote SDHA, drugi (4FE-4s in 3FE-4s) pa so v bližini prvega.
Vam lahko služi: filogenijaTreba je opozoriti, da strukturne študije kažejo, da podenota SDHB tvori vmesnik med hidrofilno katalitično domeno in domeno "sidra" do membrane (hidrofobne) kompleksa.
Hidrofobna struktura porcije
Membranalna domena kompleksa, kot je navedeno, sestavljajo SDHC (15 kDa) in SDHD (12-13 kDa) (SDH3 in SDH4 v kvasovkah), ki so oblikovani izčrpni membranski proteini, vsak pa 3 transmembranalni propelerji.
Ta domena vsebuje hemo del b združena v vmesniku med podenotami SDHC in SDHD, kjer je vsak od obeh histidinskih ligandov, ki ju držita skupaj.
V tem encimu sta bila odkrita dve sitni mesta za Ubiquinona: eno velike afinitete in eno od nizke afinitete.
Mesto visoke afinitete, znano kot QP (P mimo proksimalno) Je obraza do mitohondrijske matrice in nastane s specifičnimi aminokislinskimi ostanki, ki se nahajajo v podenotah SDHB, SDHC in SDHD.
Tudi mesto z nizko afiniteto, imenovano tudi QD (D mimo distalno) V delu notranje mitohondrijske membrane, kjer je kompleks vstavljen, bližje intermembranskemu prostoru, torej dalje od matrice organela.
Skupaj ima skupni kompleks molekulsko maso blizu 200 kDa in ugotovljeno je, da ima razmerje 4.2-5.0 flavin nanomole na miligram beljakovin in 2-4 g železa za vsak mol flavina.
Delovanje
Encimska sukcinatna kompleksna dehidrogenaza izpolnjuje pomembno funkcijo v mitohondrijih, saj ne sodeluje le v KREBS ciklu (kjer sodeluje pri razgradnji acetil -CoA), ampak tudi del dihalne verige, temeljna za proizvodnjo energije ATP.
Z drugimi besedami, je ključni encim za vmesni presnovo in aerobno proizvodnjo ATP.
- Odgovoren je za oksidacijo sukcinata do fumarata v ciklu citronske kisline
- Nahrani kompleks III elektronske transportne verige z elektroni, ki izhajajo iz oksidacije sukcinata, kar pomaga zmanjšati kisik in tvorijo vodo
- Elektronski transport ustvari elektrokemični gradient skozi notranjo mitohondrijsko membrano, ki daje prednost sintezi ATP
Kot alternativo lahko elektroni uporabimo za zmanjšanje molekul iz "bazena", kar proizvaja potrebne reduktorje za zmanjšanje anionov superoksida, ki izvirajo iz iste dihalne verige ali ki izvirajo iz eksogenih virov.
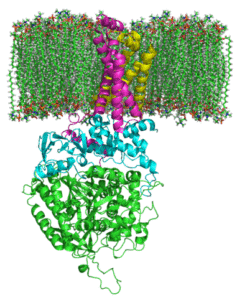
 Sukcinatni kompleksna degidrogenasa (vir: Johnhfst / javna domena, prek Wikimedia Commons)
Sukcinatni kompleksna degidrogenasa (vir: Johnhfst / javna domena, prek Wikimedia Commons) Kako deluje?
Podenota A kompleksa (ki je kovalentno povezana s koencimom FAD) se pridruži substratom, fumaratom in sukcinatom, pa tudi njegovim fiziološkim regulatorjem, oksalacetatu (konkurenčni zaviralec) in ATP.
ATP izpodriva zvezo med oksalacetatom in kompleksom SDH, nato pa se elektroni, ki so "pretekli" od sukcinata do podenote SDHA.
Vam lahko služi: miozin: značilnosti, struktura, vrste in funkcijeIz podenote B ti elektroni dosežejo hemo mesta b podenot SDHC in SDHD, od koder jih "dostavijo" v Quinonas Coencimes prek svojih sindikalnih mest do Quinonas.
Elektronski tok iz sukcinata skozi te transporterje in celo končni akceptor, ki je kisik, je povezan s sintezo 1.5 molekul ATP za vsak elektronski navor s fosforilacijo dihalne verige.
Napake Inzime
Poročalo se je, da mutacije v genu, ki kodira za podenoto A kompleksne sukcinatne dehidrogenaze, lahko povzročijo encefalopatije v otroštvu, medtem ko so mutacije v genih, ki kodirajo podenote B, C in D.
Uredba
Aktivnost kompleksne sukcinatne dehidrogenaze lahko urejamo s post -translacijskimi spremembami, kot so fosforilacija in acetilacija, Čeprav se lahko pojavi tudi inhibicija aktivnega mesta.
Acetilacija nekaterih odpadkov lizina lahko zmanjša aktivnost tega encima in ta postopek izvede encim acetilaze, znanega kot SIRT3; Fosforilacija ima enak učinek na encim.
Poleg teh sprememb so kompleks SDH urejali tudi posredniki KREBS cikla, zlasti Oksalacetat in sukcinat. Oksalacetat je močan zaviralec, medtem ko sukcinat daje prednost disociaciji oksalacetata, ki deluje kot aktivator.
Dehidrogenaza impulcinata
Dehidrogenaza sukcinata je anomalija ali mitohondrijska dihalna veriga. To pomanjkljivost povzročajo mutacije SDHA (ali SDHAF1), SDHB, SDHC in SDHD.
Različne preiskave so pokazale homozigotne in heterorozne mutacije v teh genih, zlasti SDHA. Mutacije teh genov povzročajo substitucije aminokislin v beljakovinah (v katerem koli od SDHA, B, C ali D) ali ne uspejo kodificirane nenormalno kratke beljakovine.
Zato substitucije aminokislin in nenormalno kratko kodiranje beljakovin povzročijo motnje ali spremembe encima SDH, ki povzročajo okvaro v optimalni zmogljivosti mitohondrijev za proizvodnjo energije. Tako znanstveniki imenujejo kot motnjo mitohondrijske dihalne verige.
Ta motnja se lahko v marsičem izrazi v človeku fenotipsko. Najbolj znani so: pomanjkanje ali pomanjkanje jezikovnega razvoja, spastični kvadrupleks, mišične neprostovoljne kontrakcije (distonija), mišična šibkost in miokardiopatija, med drugimi povezanimi težavami.
Nekateri bolniki z dehidrogenazo s pomanjkanjem sukcinata lahko izkazujejo Leightovo bolezen ali Kearns-Saire sindrom.
Kako se odkrije dehidrogenirano pomanjkljivost sukcinata?
Nekatere študije kažejo na uporabo kvalitativnih testov in analiz ter kvantitativne, encimske, dihalne verige biokemične analize. Drugi po drugi strani predlagajo popolno širitev verižne reakcije polimeraze (PCR) eksonov študijskih podenot in nato ustrezno zaporedje.
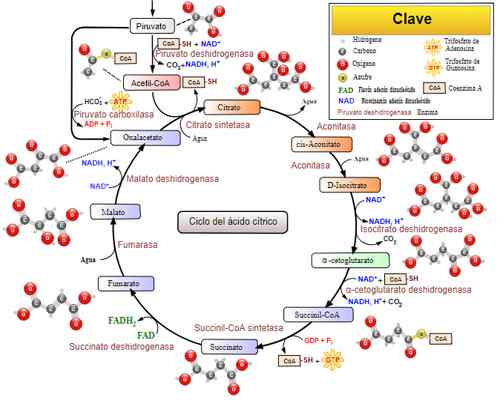 Cikel trikarboksilne kisline (KREBS cikel). Vzeli in uredili od: Narayanese, Wikiuserpedia, Yassinemrabet, Totobaggins (v španščino prevedel Alejandro Porto) [CC by-Sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)].
Cikel trikarboksilne kisline (KREBS cikel). Vzeli in uredili od: Narayanese, Wikiuserpedia, Yassinemrabet, Totobaggins (v španščino prevedel Alejandro Porto) [CC by-Sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Sorodne bolezni
Obstaja veliko fenotipskih izrazov, ki jih proizvajajo motnje mitohondrijske dihalne verige zaradi sukčastim pomanjkanja dehidrogenaze. Ko pa gre za sindrome ali bolezni, se govori o naslednjem.
Vam lahko služi: 8 najpomembnejših biogeokemičnih ciklov (opis)Leight sindrom
Gre za progresivno nevrološko bolezen, povezano z mutacijami v jedrskem genomu (v tem primeru sukcinata dehidrogenaze), ki vplivajo.
Simptomi se pojavljajo pred prvim letom posameznika, v atipičnih primerih.
Med najpogosteje opaženimi simptomi so: hipotonija z izgubo cefaličnega nadzora, neprostovoljnih gibov, ponavljajočih se bruhanju, dihalnih težavah, nezmožnosti premikanja očesnih krvnih celic, piramid in ekstrapiramidalnih znakov med drugim. Napadi niso zelo pogosti.
Možno je, da je bolezen mogoče zaznati pri prenatalnih diagnozah. Specifično zdravilo ali zdravljenje ni znano, vendar nekateri strokovnjaki predlagajo zdravljenje z določenimi vitamini ali kofaktorji.
Prebavni tumor strome (GIST)
Običajno ga imenujemo GIST, je vrsta tumorja prebavil, ki se na splošno razvija na območjih, kot sta želodec ali tanko črevo. Verjame se, da je vzrok za določeno skupino visoko specializiranih celic, imenovanih ICC celice ali intersticijske celice Cajala.
Drugi dejavniki o vzroku GIST -a so mutacije nekaterih vrst genov, ki po nekaterih avtorjih povzročajo 90% tumorjev. Vključeni geni so: KIT, PDGFRA Geni, dehidrogenaza sukcinat (SDH) - Slabi.
Sukcinatna dehidrogenaza (SDH) - slaba, se pojavlja predvsem pri mladih ženskah, proizvaja želodčne tumorje in z relativno frekvenco proizvaja metastaze v bezgavkah. Majhen odstotek se pojavi pri otrocih in v večini primerov, je posledica pomanjkanja izražanja podenote SDHB.
Kearns-Sayre sindrom
Ugotovljeno je bilo, da lahko nekateri bolniki s pomanjkanjem sukcinatne dehidrogenaze kažejo sindrom Kearns-Sayre. Ta bolezen je povezana z mitohondrijskimi motnjami, za nje pa je značilna odsotnost gibanja očesnih balonov.
Druge značilnosti te bolezni so pigmentarni retinitis, gluhost, kardiomiopatija in pogoji centralnega živčnega sistema. Običajno te simptome opazimo, preden bolnik dopolni 20 let. Za to stanje ni znana prenatalna diagnoza.
Prav tako ni zdravilo za to bolezen. Zdravljenje je paliativno, to je le za zmanjšanje učinkov bolezni, ne pa zdravila. Po drugi strani, čeprav je odvisno od števila prizadetih organov in prejete zdravstvene oskrbe, je pričakovana življenjska doba razmeroma normalna.
Reference
- Ackrell, b. Do., Kearney, e. B., & Pevec, t. Str. (1978). [47] Sesalci sukcinat dehidrogenaza. V metodah v encimologiji (vol. 53, str. 466-483). Akademski tisk.
- Brère, j. J., Favier, J., Ghouzzi, v. In., DJudi, f., Benit, str., Gimenez, a. Str., & Rustin, str. (2005). Sukcinat primanjkljaj dehidrogenaze pri človeku. CMLS celične in molekularne življenjske vede, 62 (19–20), 2317-2324.
- Cecchini, g., Schröder, i., Gunalus, r. Str., & Maklashina in. (2002). Sukcinatna dehidrogenaza in fumeratna redaktaza iz Escherichia coli. Biochimica et Biophysica Acta (BBA) -Bioenergetics, 1553 (1-2), 140-157.
- Hatefi in., & Davis, k. Do. (1971). Sukcinatna dehidrogenaza. Yo. Čiščenje, molekularne lastnosti in podkonstruktura. Biokemija, 10 (13), 2509-2516.
- Hederstedt, l. Do. R. S., & Rutberg, L. Do. R. S. (1981). Primerjalni pregled sukcinata dehidrogenaze-A. Mikrobiološki pregledi, 45 (4), 542.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehningerjeva načela biokemije. Macmillan.
- Rutter, j., Winge, d. R., & Schiffman, J. D. (2010). Sukcinat-dehidrogenaza-asemble, regulacija in vloga pri človeškem diefu. Mitohondrion, 10 (4), 393–401.
- « Essential maščobne kisline, pomembnost, nomenklatura, primeri
- Pravila T funkcije, tako da služi, primeri »

