Solvacija
- 2444
- 411
- Roman Schamberger
Kaj je solvacija?
The Solvacija To je fizikalna in kemična zveza med delci topila in topila v raztopini. Od koncepta topnosti se razlikuje po tem, da ni termodinamičnega ravnovesja med trdno snovjo in njenimi raztopljenimi delci.
Ta zveza je odgovorna za to, da razpuščene trdne snovi "izginejo" glede na gledalce; Ko v resnici delci postanejo zelo majhni in na koncu "zavijejo" z molekulami topila, zaradi česar jih ni mogoče opazovati.

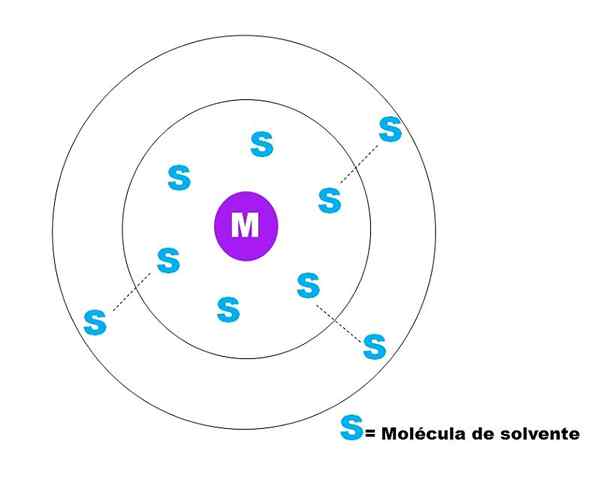
Na zgornji sliki je predstavljena zelo splošna skica solvacije delca m. M je lahko v redu (m+) ali molekula; In S je molekula topila, ki je lahko vsaka spojina v tekočem stanju (čeprav je lahko tudi plin).
Upoštevajte, da je M obkrožen s šestimi S, ki sestavljajo tisto, kar je znano kot Primarna solvacijska sfera. Druge M molekule na višji razdalji medsebojno vplivajo na sile Van der Waals, ki tvorijo sekundarno sfero za reševanje in tako naprej, dokler ni razvidno iz kakršnega koli naročila.
Proces solvacije
 Vir: Gabriel Bolívar
Vir: Gabriel Bolívar Molekularno, kako je proces solvacije? Zgornja slika povzema potrebne korake.
Molekule topila, modre, so sprva naročene, da medsebojno komunicirajo (S-S); In delci (ioni ali molekule) topljene, vijolične, delajo enako z močnimi ali šibkimi M-M interakcijami.
Da se solvacija pojavi, se morata topila in topila razširiti (druga črna puščica), da omogoči interakcije med topilnimi topili (M-S).
To nujno pomeni zmanjšanje interakcij med topilnimi topili in topili; zmanjšanje, ki zahteva energijo, zato je ta prvi korak endotermičen.
Ko se topilo in topilo molekularno razširita, tako mešamo in izmenjava mesta v vesolju. Vsak vijolični krog druge slike je mogoče primerjati s prvo sliko.
Vam lahko služi: kalcij: lastnosti, struktura, pridobi, uporabiSprememba stopnje urejanja delcev je mogoče podrobno opisati na sliki; Naročeno na začetku in na koncu zmedeno. Posledično je zadnji korak eksotermičen, saj tvorba novih interakcij stabilizira vse delce raztopine.
Energetski vidiki
Za postopkom solvacije je treba upoštevati veliko energetskih vidikov. Prvi: Interakcije S-S, M-M in M-S.
Kadar so M-S interakcije, torej med topilom in topilom, veliko boljše (močne in stabilne) v primerjavi s posameznimi komponentami, govori o eksotermičnem procesu reševanja; In zato se energija sprosti v okolje, ki jo je mogoče preveriti z merjenjem zvišanja temperature s termometrom.
Če so med nasprotno interakcije M-M in S-S močnejše od M-S, potem bo za "razširitev" potreboval več energije od tiste, ki jo zaslužijo, ko bodo solvacija končala vrhunec.
Nato se govori o procesu endotermičnega reševanja. Ker je ta primer, se znižanje temperature ali kaj je enako, okolica se ohladi.
Obstajata dva temeljna dejavnika, ki vladata, ali se topljen ali ne raztopi v topilu. Prva je sprememba raztopine raztapljanja (ΔHDis), Kot je razloženo, in druga je sprememba entropije (ΔS) med topilo in raztopljeno topilo. Na splošno je ΔS povezan z zgoraj omenjenim povečanjem motnje.
Medmolekularne interakcije
Omenjeno je bilo, da je solvacija posledica fizikalne in kemične zveze med topilom in topilom; Kako točno so te interakcije ali sindikate?
Če je topka ion, m+, Izdelani so tako imenovani ionski dipolo (m+-S); In če gre za molekulo, bodo na voljo dipol-dipolo interakcije ali londonske disperzijske sile.
Vam lahko služi: cikloheksan: struktura, uporabe, konformacijeKo govorimo o interakcijah dipolo-dipolo, se reče, da je v M in S trajni dipolni trenutek. Tako regija, bogata z elektroni δ- M, deluje s slabim območjem elektrona δ+ S. Rezultat vseh teh interakcij je tvorba več sfer solvacije okoli m.
Poleg tega obstajajo tudi druge vrste interakcij: koordinativno. Tukaj molekule koordinacijske povezave s tvorbo (ali dativ) z m, ki tvorijo različne geometrije.
Temeljno pravilo za zapomnitev in napovedovanje afinitete med topilom in topilom je: Enako raztopi enako. Zato se polarne snovi z veliko lahkoto raztopijo v topilih, enako polarnih; in apolarne snovi, se raztopijo v apolarnih topilih.
Razlike med solvacijo in hidracijo
 Vir: Gabriel Bolívar
Vir: Gabriel Bolívar Kako se razlikuje reševanje hidracije? Dva enaka procesa, razen zato, ker S S, prve slike, nadomeščata voda, H-O-H.
Na vrhunski sliki lahko vidite kation m+ Obkroženo s šestimi h molekulami2Tudi. Upoštevajte, da so atomi kisika (rdeča) usmerjeni v pozitivno obremenitev, ker je najbolj elektronegativna in ima zato največjo negativno gostoto δ-.
Za prvo sfero hidracije so druge molekule vode razvrščene po vodikovih mostovih (OH2-Oh2). To so interakcije med ionsko-dipolo. Vendar lahko molekule vode tvorijo tudi koordinacijske vezi s pozitivnim centrom, še posebej, če je kovinsko.
Tako je znani Akokokomplejos, m (oh2)n. Kot n = 6 na sliki je šest molekul usmerjenih okoli M v oktaedri koordinacije (notranja sfera hidracije). Odvisno od velikosti m+, Obseg njegove obremenitve in njegova elektronska razpoložljivost je dejal, da je sfera lahko manjša ali večja.
Vam lahko služi: krom oksid (iii): struktura, nomenklatura, lastnosti, uporabeVoda je morda najbolj presenetljivo topilo od vseh: raztopi neizmerno količino topljencev, je topilo preveč polarno in ima nenormalno visoko dielektrično konstanto (78.5 K).
Primeri reševanja
Spodaj so trije primeri solvacije v vodi.
Kalcijev klorid
Pri raztapljanju kalcijevega klorida v vodi se toplota sprosti, ko se rešujejo kationi2+ in cl anions-. Ca2+ Obkrožen je s številnimi molekulami vode, ki so enake ali večji od šest (CA2+-Oh2).
Tudi CL- Obdan je z vodikovimi atomi, območjem Δ+ vode (Cl--H2Da). Sproščena toplota se lahko uporablja za topljene mase.
Sečnina
V primeru sečnine je organska molekula s H strukturo2N-Co-NH2. Pri reševanju h molekule h2O Oblikujte vodikove mostove z dvema skupinama AMING (-NH2-Oh2) in s karbonilno skupino (c = o- h2Da). Te interakcije so odgovorne za njihovo veliko topnost v vodi.
Tudi njegovo raztapljanje je endotermično, to je, da ohladi posodo za vodo, kamor se doda.
Amonijev nitrat
Amonijev nitrat, kot sečnina, je topilo, ki hladi raztapljanje po solvaciji ionov. NH4+ Solvata podobno kot ca2+, Čeprav je verjetno zato, ker je tetraedrska geometrija manj molekul H2Ali okoli njega; In ne3- Solvata na enak način kot Cl Anions- (Oh2-Tudi2Ne- h2Da).
Reference
- Whitten, Davis, Peck & Stanley. Kemija. (8. izd.). Cengage učenje.
- Belford r. (s.F.). Solvacijski procesi. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Guppy Surf. (s.F.). Proces solvacije. Pridobljeno iz: SurfGUPY.com

