Koncentrirana raztopina
- 1467
- 437
- Don Nitzsche
Kaj je koncentrirana rešitev?
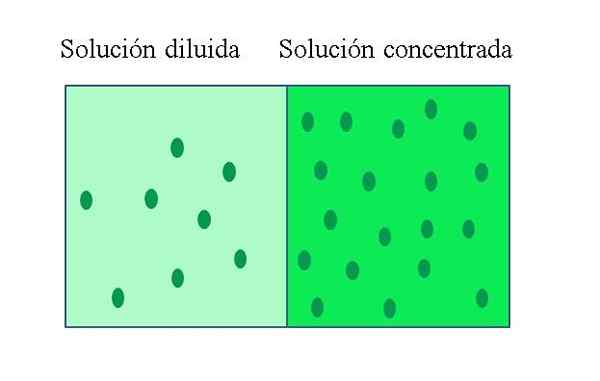
A koncentrirana raztopina Je ena, ki vsebuje veliko količino topljene glede na količino, ki bi jo lahko raztopila. Nasprotno, razredčena raztopina ima nizko koncentracijo topljenega. Razdeljeno raztopino lahko pripravimo iz koncentrirane raztopine z dodajanjem topila ali če je mogoče, ekstrahiranje topila.
Koncept je lahko relativni, saj je tisto, kar definira koncentrirano raztopino, visoke vrednosti v nekaterih njegovih lastnostih; Na primer, meringue Mantecado ima visoko koncentracijo sladkorja, kar dokazuje njegov sladki okus.
 Vir: Gabriel Bolívar
Vir: Gabriel Bolívar Koncentracija topila koncentrirane raztopine je blizu ali enaka koncentraciji v nasičeni raztopini. Glavna značilnost nasičene raztopine je, da pri določeni temperaturi ne more solubizirati dodatne količine topljenosti. Zato koncentracija topljenca v nasičenih raztopinah ostaja konstantna.
Topnost večine topljencev se poveča, ko se temperatura povečuje. Na ta način lahko v nasičeno raztopino solulizirate dodatno količino topljene.
Nato se z znižanjem temperature poveča koncentracija topne nasičene raztopine. Pogovor je v tem primeru prenasičene rešitve.
Značilno za koncentrirano raztopino
Koncentracija raztopine, to je razmerje med količino topljene in količine raztopine ali topila, se lahko v raztopini izrazi kot odstotek topljenca (P/V ali P/P).
Lahko se izraža tudi v molih iz topljene raztopine (molarnost) in topnih ekvivalentov na liter raztopine (normalnost).
Običajno je tudi izraziti koncentracijo raztopine v molih topila na kilogram topila (molealnost) ali jo izraziti v molih topljenosti glede na skupne mole raztopine (molarna frakcija). V razredčenih raztopinah je običajno najti koncentracijo raztopine v P.str.m. (deli na milijon).
Vam lahko služi: viskoznost: primeri, vzroki, enote, vrsteNe glede na obliko izražanja koncentracije raztopine ima koncentrirana raztopina velik delež topljenega, v tem primeru izražen kot masa, glede na maso ali prostornino raztopine ali topilo. Ker je ta koncentracija enaka topnosti topila v topilu ali zelo blizu njene vrednosti.
Koligacijske lastnosti rešitev
So niz lastnosti rešitev, ki so odvisne od števila delcev v raztopini, ne glede na njegovo vrsto.
Koligacijske lastnosti ne razlikujejo med značilnostmi delcev, če so natrij, klor, glukoza itd. Pomembno je vaša številka.
Zaradi tega dejstva je bilo treba ustvariti drugačen način izražanja koncentracije raztopine, ki se nanaša na tako imenovane koligativne lastnosti. Kot odgovor na to so bili ustvarjeni osmolarnost in osmolalnost.
Osmolarnost in osmolalnost
Osmolarnost je povezana z molarnostjo raztopine in osmolalnosti z njegovo molealnostjo.
Osmolarity enote so OSM/L raztopine ali MOSM/L raztopine. Medtem ko so enote osmolalnosti OSM/kg vode ali MOSM/kg vode.
Osmolarnost = mvg
M = molarnost raztopine.
v = število delcev, v katerih spojina v vodni raztopini disociira. Na primer: za NACl ima V vrednost 2; Za cacl2, V ima vrednost 3 in za glukozo, ne -električno spojino, ki se ne disociira, V ima vrednost 1.
g = osmotski koeficient, korekcijski faktor za interakcijo električno nabitih delcev v raztopini. Ta korekcijski faktor ima vrednost blizu 1 za razredčene raztopine in se nagiba na nič, saj se molarnost elektrolizne spojine poveča.
Vam lahko služi: laboratorijska malta: značilnosti, funkcije, uporabeSpodaj so omenjene koligacijske lastnosti, ki omogočajo določitev, koliko je rešitev koncentrirana.
Parni tlak spušča
Ko se voda segreje, se izhlapi in nastala para. Ko se doda Soluto, se tlak pare zmanjšuje.
Zato imajo koncentrirane raztopine nizke pare. Pojasnilo je, da se molekule topljene premikajo na molekule vode v vmesniku Agua-Aire.
Crioskopska točka se zmanjšuje
Ko osmolarnost raztopine poveča temperaturo, pri kateri je zamrznjena vodna raztopina. Če je temperatura zamrzovanja čiste vode 0 ° C, je temperatura zamrzovanja koncentrirane vodne raztopine nižja od te vrednosti.
Vrhunska višina točke embluticije
Po Raaultovem zakonu je dviga vrelišča čistega topila neposredno sorazmerna z molarnostjo raztopine, ki izvira z dodajanjem topljenega. Zato imajo koncentrirane raztopine višjo vrelišče kot voda.
Osmotski tlak
Obstajata dva predela z različnimi koncentracijami, ločena z membrano, ki omogoča, da voda prehaja, vendar omejuje prehod topnih delcev.
Voda bo tekala iz raztopine, ki ima nižjo koncentracijo topljenega do raztopine, ki ima večjo koncentracijo topljenega.
Ta neto pretok vode bo izginil, ko voda, nakopičena v predelu z najvišjo koncentracijo, ustvari hidrostatični tlak, ki nasprotuje pretoku vode v ta predal.
Lahko vam postreže: difenilaminPretok vode z osmozo se na splošno pojavi v smeri koncentriranih raztopin.
Razlike med koncentrirano raztopino in razredčeno raztopino
-Koncentrirane raztopine imajo velik delež topljenosti glede na volumen ali maso raztopine. Razredčene raztopine imajo nizko topno delež glede na volumen ali maso raztopine.
-Imajo molarnost, molealnost in normalnost, večjo od tistih, ki jih predstavljajo razredčene rešitve.
-Zamrzovalna točka koncentriranih raztopin je nižja kot pri razredčenih raztopinah; to pomeni, da zamrznejo pri hladnejših temperaturah.
-Koncentrirana raztopina ima manj tlaka pare kot razredčena raztopina.
-Koncentrirane raztopine imajo višjo vrelišče kot tisto, ki jo predstavljajo razredčene raztopine.
-Stik skozi polprevodno membrano, voda bo tekala iz razredčenih raztopin do koncentriranih raztopin.
Primeri rešitev
Koncentrirano
-Med je nasičena raztopina sladkorja. Običajno je opazovati pojav rekristalizacije sladkorja, ki je razvidno iz tapasov zabojnikov, ki vsebujejo med.
-Morska voda, ki ima visoko koncentracijo različnih soli.
-Urin ljudi s hudo dehidracijo.
-Karzirana voda je raztopina nasičenega ogljikovega dioksida.
Razredčen
-Urin osebe s prekomernim vnosom vode.
-Znoj je običajno nizka osmolarnost.
-Številna zdravila, dobavljena v raztopini, imajo nizko koncentracijo.
Reference
- Wikipedija. Koncentracija. Okrevano od: je.Wikipedija.org
- Fusta l. Koncentracija rešitev: definicija in ravni. Študij. Okrevano od: študij.com
- Vodne raztopine - molarnost. Okrevano od: kem.UCLA.Edu
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.

