Komponente hipotonske raztopine, priprava, primeri
- 4367
- 1222
- Adrian Legros
A Hipotonična rešitev To je ena, ki predstavlja koncentracijo manjšega topka glede na raztopino, ločeno ali izolirano s polprevodnim hroščem. Ta pregrada omogoča, da topilo v primeru bioloških sistemov, vendar ne vsi delci topljencev.
Telesne tekočine znotrajceličnih in zunajceličnih vretenčarjev imajo osmolarnost okoli 300 msm/l. Medtem ko se šteje, da ima hipotonska tekočina osmolarnost manjša od 280 msm/l. Torej je raztopina te osmolarnosti hipotonična glede na celični medij.
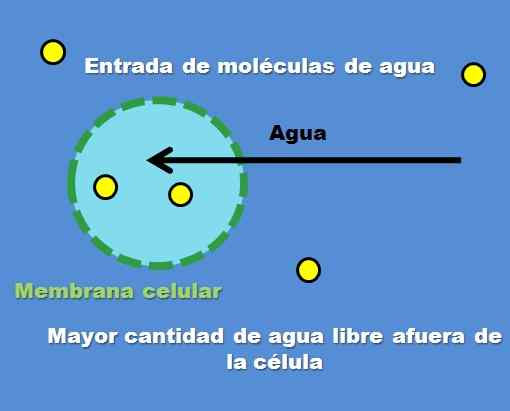
 Interakcija celice s hipotonično raztopino. Vir: Gabriel Bolívar.
Interakcija celice s hipotonično raztopino. Vir: Gabriel Bolívar. Primer hipotonske raztopine je 0,45% natrijevega klorida. Kako pa se celica ali predal obnaša pred to vrsto rešitve? Vrhunska slika odgovori na to vprašanje.
Koncentracija topnih delcev (rumene točke) je v zunanji celici višja. Če ima manj topljene celice, je več prostih molekul vode, zato je predstavljena z intenzivnejšo modro barvo v primerjavi z notranjostjo celice.
Voda teče navzven skozi osmozo do koncentracije. Kot rezultat, se celica širi ali ventilira tako, da absorbira vodo, ki prečka svojo celično membrano.
[TOC]
Sestavni deli hipotoničnih rešitev
Hipotonične rešitve so sestavljene iz topila, ki je, razen če ni drugače navedeno, sestavljeno iz vode, in topila, raztopljenih v njej, kot so soli, sladkorji itd., v čisti ali mešani obliki. Toda ta rešitev ne bo imela nobene toničnosti, če ni polpreminske pregrade, ki postane celična membrana.
Lahko vam služi: kalcijev nitrat (CA (NO3) 2)Raztopljenih soli mora biti malo, tako da je njegova koncentracija majhna, medtem ko je "koncentracija" vode visoka. Če ima več proste vode zunaj celice, to pomeni, da ne rešuje ali hidrirajoči delci topljenosti, večji je pritisk na celično membrano in več ga bo prekrižalo, da bi razredčilo znotrajcelično tekočino.
Priprava hipotonične raztopine
Za pripravo teh rešitev sledi isti protokol kot sledi za druge rešitve. Izdelani so ustrezni izračuni mase topljencev. Potem jih tehtamo, se raztopimo v vodi in vzamemo zastavo, ki jo deli v glasnosti, ki ji ustreza.
Hipotonična raztopina ima nizko osmolarnost, običajno manj kot 280 MOSM/L. Torej pri pripravi hipotonične raztopine moramo izračunati vašo osmolarnost tako, da je njegova vrednost manjša od 280 msm/l. Osmolarnost je mogoče izračunati z naslednjo enačbo:
Osmolarnost = m · v · g
Kje m Je molarnost topljene in v Število delcev, v katerih je spojina disociirana v raztopini. Ne -električne snovi ne disociirajo, zato je vrednost V enaka 1. To je primer glukoze in drugih sladkorjev.
Medtem g je osmotski koeficient. To je korekcijski faktor za interakcijo električno nabitih delcev (ionov) v raztopini. Za razredčene raztopine in ne -dissiatiatne snovi, na primer in spet glukoza, se vzame vrednost g, enaka 1. Nato je rečeno, da je molarnost enaka njegovi osmolarnosti.
Primer 1
Pripravite raztopino natrijevega klorida (NACL) pri 0,5 % (P/V) in preverite, ali gre za hipotonično rešitev ali ne. NaCl molekulska teža = 58,5 g/mol.
Opravljena je 0,5 % Gram NaCl raztopino na liter:
Vam lahko služi: kalcijev peroksid (caO2): lastnosti, tveganja in uporabeNaCl v g/l = (0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
In nadaljujemo z izračunom njene molarnosti in nato določimo njegovo osmolarnost:
Molarnost = masa (g/l) ÷ molekulska masa (g/mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 molov/l
NaCl disociira v dveh delcih: Na+ (kation) in cl- (anion). Torej vrednost v = 2. Tudi zato, ker gre za razredčeno 0,5 %raztopino NaCl, lahko domnevamo, da je vrednost G (osmotski koeficient) 1. Takrat imamo:
Osmolarnost (naCl) = molarnost · v · g
= 0,085 m · 2 · 1
= 0,170 OSM/L O 170 MOSM/L
To je hipotonična rešitev, saj je njegova osmolarnost precej nižja od referenčne osmolarnosti za telesne tekočine, ki je plazemska osmolarnost, katerih vrednost je približno 300 MOSM/L L L.
Primer 2
Pripravite raztopino mešanice kalcijevega klorida (CACL2) pri 0,055 % (P/V) in glukoza (C6H12Tudi6) pri 4 % (P/V). Molekulske teže: cacl2 = 111 g/mol in c6H12Tudi6 = 180 g/mol.
Izračunamo molarnost, ki ima koncentracije ustreznih topil pri 0,55 g/L in 40 g/L:
Molarnost (Cacl2) = 0,55 g/l ÷ 111 g/mol
= 4,95 · 10-3 M
= 4,95 mm
Molarnost (c6H12Tudi6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
In na enak način izračunamo osmolarnosti, vemo, da klik2 Disociira na treh ionih, dva Cl- In ca2+, in ob predpostavki, da so zelo razredčene rešitve, zato vrednost v Je 1. Imamo:
Osmolarnost (Cacl2) = 4,95 mm · 3 · 1
= 14,85 MOSM/L
Osmolarnost (c6H12Tudi6) = 222 mm · 1 · 1
= 222 MOSM/L
Končno celotna osmolarnost raztopine postane vsota posameznih osmolarnosti; to je od tistih iz NaCl in glukoze. To je torej:
Vam lahko služi: ognjevzdržni materialiSkupna osmolarnost raztopine = cacl osmolarnost2 + Osmolarnost c6H12Tudi6
= 222 MOSM/L + 14,85 MOSM/L
= 236,85 MOSM/L
Raztopina mešanice kalcija in glukoznega klorida je hipotonična, saj je njegova osmolarnost (236,85 MOSM/L) veliko manjša od osmolarnosti v plazmi (300 MOSM/L), ki se jemlje kot referenca.
Primeri hipotoničnih rešitev
Raztopina natrijevega klorida
0,45 % raztopine natrijevega klorida se intravensko daje bolnikom s sladkorno ketozo, ki razvijejo dehidracijo v intersticijskih in znotrajceličnih oddelkih. Voda teče iz plazme v te predelke.
Ringer laktat raztopina
Ringer Laktat Rešitev št. 19 je še en primer hipotonične raztopine. Njegova sestava je 0,6 g natrijevega klorida, 0,03 g kalijevega klorida, 0,02 g kalcijevega klorida, 0,31 g natrijevega laktata in 100 ml destilirane vode. To je rešitev, ki se uporablja za rehidracijo bolnikov in je rahlo hipotonična (274 MOSM/L).
Reference
- Od Lehr Spilva, do. In muktans in. (1999). Vodnik po farmacevtskih specialitetah v Venezueli. XXXVª izdaja. Globalne izdaje.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2020). Toničnost. Pridobljeno iz: v.Wikipedija.org
- Union Media LLC. (2020). Izotonične, hipotonične in hipertonične rešitve. Pridobljeno od: UnionTestPrep.com
- Lodish H, Berk A, Zipursky SL in drugi. (2000). Oddelek 15.8osmoza, vodni kanali in uravnavanje volumna celic. NCBI knjižna polica. Okreval od: NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- John Brennan. (13. marec 2018). Kako izračunati izotoničnost. Okrevano od: Znanstvenik.com
- « Matilde Hidalgo de Prince Biografija, prispevki in dela
- 15 najpomembnejših gledaliških značilnosti »

