Zgodovina silicija, lastnosti, struktura, pridobivanje, uporabe

- 2911
- 808
- Don Nitzsche
On silicij Je nemetalni element in hkrati metaloid, ki ga predstavlja kemični simbol, če. Je polprevodnik, ki je bistveni del računalnikov, kalkulatorjev, mobilnih telefonov, sončnih celic, diod itd.; Praktično je glavna komponenta, ki je omogočila poravnavo digitalne dobe.
Silicij je že od nekdaj prisoten v krementu in silikatih, oba minerala, ki sta sestavljala približno 28% v masi celotne Zemljine skorje. To je torej drugi najpogostejši element na površini zemlje, prostranost puščav in plaž.
 Puščave so obilen naravni vir delcev silicijevega dioksida ali granitov z drugimi minerali. Vir: pxhere.
Puščave so obilen naravni vir delcev silicijevega dioksida ali granitov z drugimi minerali. Vir: pxhere. Silicij spada v skupino 14 periodične tabele, enako kot ogljik, ki se nahaja pod tem. Zato ta element velja za tetravalentni metaloid; Ima štiri elektrone Valencije in teoretično jih lahko izgubite, da tvorijo kation, če4+.
Nepremičnina, ki se deli s premog, je njegova sposobnost združevanja; to pomeni, da so njihovi atomi kovalentno povezani, da definirajo molekularne verige. Prav tako lahko silicij tvori svoje "ogljikovodike", imenovane siltani.
Prevladujoče spojine silicija v naravi so slavni silikati. V svoji čisti obliki se lahko pojavi kot trden monokristalni, poliristalinski ali amorfni. Je relativno inertna trdna, zato ne predstavlja velikih tveganj.
[TOC]
Zgodovina
Silicijev kamen
Silicij je morda eden izmed elementov, ki je najbolj vplival na zgodovino človeštva.
Ta element je glavni junak kamene dobe in tudi digitalne dobe. Njihov izvor sega, ko so civilizacije delale s kremenčem in si pripravile kozarec; In trenutno je glavna sestavina računalnikov, prenosnikov in pametnih telefonov.
Praktično je bil silicij kamen dveh erov, jasno opredeljenih v naši zgodovini.
Izolacija
Ko je bil silicijev dioksid tako obilen, ime, rojeno iz Flint Rock, je moralo vsebovati izjemno bogat element v Zemljini skorji; To je bil uspešen sum Antoina Lavoisierja, ki leta 1787 ni uspel v svojih poskusih, da bi ga zmanjšala iz svojega oksida.
Nekaj časa kasneje, leta 1808, je Humphry Davy po svoje poskusil in dodelil svoje ime elementu: "Silicij", ki bi bil preveden kot "pedernal metal". To pomeni, da je silicij do takrat veljal za kovino zaradi pomanjkanja karakterizacije.
Nato leta 1811 francoski kemiki Joseph L. Gay-Lussac in Louis Jacques Thénard sta uspela prvič pripraviti amorfni silicij. Za to so reagirali na silicijev tetrafluorid s kovinskim kalijem. Vendar pa pridobljenega izdelka niso očistili ali označili, zato niso sklepali, da gre za nov element silicija.
Ni bilo nič drugega kot leta 1823, ko je švedski kemik Jacob Berzelius dobil amorfni silicij z zadostno čistostjo, da ga je prepoznal kot silicij; ime, ki ga je leta 1817 dal škotski kemik Thomas Thomson, ko ga obravnava kot ne -metalni element. Berzelius je izvedel reakcijo med kalijem in staljenim kalijevim fluorozilikatom, da je ustvaril ta silicij.
Kristalni silicij
Kristalni silicij je prvič pripravil leta 1854 francoski kemik Henry Deville. Da bi to dosegel, je DeVille naredil elektrolizo mešanice aluminijevih in natrijevih kloridov, s čimer je pridobil silicijeve kristale, pokrite s plastjo aluminijaste siliciuro.
Fizikalne in kemijske lastnosti
Fizični videz
 Osnovni silicij, ki ima kovinski sijaj, vendar je pravzaprav metaloid. Vir: Hi-ločke slike kemijskih elementov [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]
Osnovni silicij, ki ima kovinski sijaj, vendar je pravzaprav metaloid. Vir: Hi-ločke slike kemijskih elementov [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] Silicij v svoji čisti ali osnovni obliki je sestavljen iz modrikasto sivkasto ali črne trdne snovi (nadrejena podoba), ki čeprav ni kovina, predstavlja svetle obraze, kot da je res.
To je trda, a krhka trdna snov, ki ima tudi ploščato površino, če jo tvorijo poliristale. Po drugi strani je amorfni silicij videti kot temno rjava trdna snov v prahu. Zahvaljujoč temu je enostavno prepoznati in razlikovati eno vrsto silicija (kristalni ali poliristalin) iz druge (amorfno).
Molarna masa
28.085 g/mol
Atomsko število (z)
14 (14Ja)
Tališče
1414 ° C
Vrelišče
3265 ° C
Gostota
-Pri sobni temperaturi: 2,33 g/ml
-Desno na tališču: 2,57 g/ml
Upoštevajte, da je tekoči silikon gostejši od trdnega silicija; kar pomeni, da bodo njihovi kristali plavali na tekoči fazi, kot pri sistemu ledene vode. Pojasnilo je posledica dejstva, da je interatomski prostor med atomi, če je v njegovem steklu večji (manj gost), kot ustrezen v tekočini (gosteč).
Fuzijska toplota
50,21 kJ/mol
Toplota za uparjanje
383 kJ/mol
Molarna toplotna sposobnost
19.789 J/(mol · k)
Elektronegativnost
1,90 na lestvici Pauling
Ionizacijske energije
-Prvi: 786,5 kJ/mol
-Drugi: 1577.1 kJ/mol
-Tretjič: 3231,6 kJ/mol
Atomski radio
111 PM (merjeno v njihovih diamantnih kristalih)
Toplotna prevodnost
149 w/(m · k)
Električna upornost
2.3 · 103 Ω · m do 20 ° C
Mohs trdota
6.5
Združevanje
Silicijevi atomi imajo možnost oblikovanja preprostih si-si povezav, ki na koncu določijo verigo (Si-si-si ...).
To lastnost se kažejo tudi ogljik in žveplo; Vendar hibridizacije SP3 silicija so bolj pomanjkljivi v primerjavi z drugim dvema elementoma, poleg tega pa so njihove 3P orbitale bolj razpršene, zato prekrivanje orbital SP3 Rezultat je šibkejša.
Vam lahko služi: eksotermične in endotermične reakcijePovprečne energije kovalentnih vezi Si-Si in C-C so 226 kJ/mol oziroma 356 kJ/mol. Zato so povezave SI-IF šibkejše. Zaradi tega silicij ni temelj življenja (niti žveplo). Pravzaprav je najdaljša veriga ali okostje, ki ga lahko tvori silicij, običajno štirje člani (če4).
Oksidacijske številke
Silicij ima lahko katero koli od naslednjih oksidacijskih številk, ob predpostavki, da obstoj ionov z ustreznimi obremenitvami: -4 (da4-), -3 (da3-), -2 (da2-), -1 (da-), +1 (da+), +2 (da2+), +3 (da3+) in +4 (da4+). Od vseh sta -4 in +4 najpomembnejša.
Na primer -4 se domneva v Siliciurosu (MG2Da ali mg22+Ja4-); medtem ko +4 ustreza tistemu kremenčemu (SIO2 ali če4+Tudi22-).
Reaktivnost
Silicij je popolnoma netopen v vodi, pa tudi močne kisline ali baze. Vendar se raztopi v koncentrirani mešanici dušikovih in fluorhorhoričnih kislin (HNO3-Hf). Prav tako se raztopi v vroči alkalni raztopini, ki se pojavi naslednja kemična reakcija:
Da (s) + 2naOH (AC) + H2Ali (l) => na2Sio3(AC) + 2H2(g)
Natrijev metasilicat, na2Sio3, Nastane se tudi, ko se silicij raztopi v staljenem natrijevem karbonatu:
Da (s) + na2Co3(L) => na2Sio3(L) + c (s)
Pri sobni temperaturi sploh ne reagira s kisikom, niti pri 900 ° C, ko se začne oblikovati zaščitna steklasta plast Siio2; In potem silicij pri 1400 ° C reagira z zračnim dušikom, da tvori mešanico nitriranja, brez in če3N4.
Silicij reagira tudi pri visokih temperaturah s kovinami, da tvori kovinski siliciuros:
2mg (s) + da (s) => mg2Da (s)
2CU (s) + da (s) => cu2Da (s)
Pri sobni temperaturi reagira eksplozivno in neposredno s halogeni (ni sloja SiO2 ki ga ščiti pred tem). Na primer, imate reakcijo tvorbe SIF4:
Da (s) + 2f2(g) => sif4(g)
In čeprav je silicij v vodi netopen, Red Alive reagira s parnim tokom:
Da (s) + h2Ali (g) => si2(s) + 2h2(g)
Elektronska struktura in konfiguracija
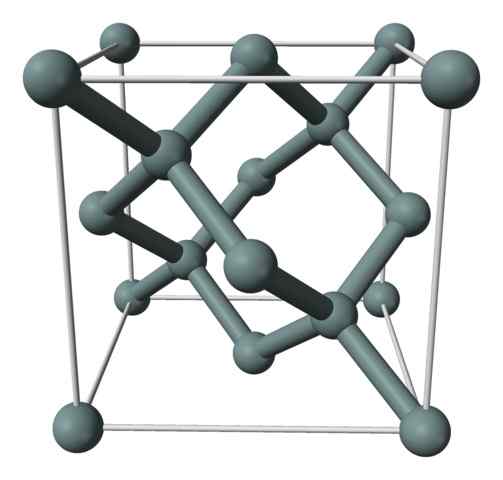 Kristalna struktura ali enotna celica silicija, predstavljena z modelom kroglic in palic. Vir: Benjah-BMM27 [javna domena]
Kristalna struktura ali enotna celica silicija, predstavljena z modelom kroglic in palic. Vir: Benjah-BMM27 [javna domena] Zgornja slika prikazuje kubično strukturo, osredotočeno na obraze (FCC), enako kot diamant, za silicijev kristal. Sive sfere ustrezajo atomom, če so, kot so cenjene, kovalentno povezane med seboj; Poleg tega imajo tetraedrska okolja, ki se razmnožujejo vzdolž stekla.
Silicijev kristal je FCC, ker opazimo atom, če se nahaja na vsakem obrazu kocke (6 × 1/2). Obstaja tudi osem atomov, če je v točki kocke (8 × 1/8) in štirje v sebi (tisti, ki prikazujejo dobro definirano tetraeder okoli njih, 4 × 1).
Rekel je zgoraj navedeno, da ima vsaka enotna celica skupno osem silicijevih atomov (3 + 1 + 4, številke, navedene v zgornjem odstavku); Značilnost, ki pomaga razložiti njegovo visoko trdoto in togost, saj je čisti silicij kovalentni kristal in tudi diamant.
Kovalentni lik
Ta kovalentni značaj je posledica dejstva, da ima silicij, tako kot ogljik, štiri valenčne elektrone v skladu z njegovo elektronsko konfiguracijo:
[NE] 3S2 3P2
Za povezavo sta čisti orbitali 3s in 2p neuporabni. Zato atom ustvari štiri hibridne orbitale SP3, S katerim lahko oblikujete štiri kovalentne vezi Si-Si in na ta način dokončate okto Valencia za dva silicijeva atoma.
Silicijev kristal se nato vizualizira kot kovalentno in tridimenzionalno omrežje, sestavljeno iz medsebojno povezanih tetraedrov.
Vendar to omrežje ni popolno, saj predstavlja napake in omejitve zrn, ki ločijo in definirajo kristal od drugega; In ko so takšni kristali zelo majhni in številni, se govori o poliristalinski trdni snovi, ki jo identificirajo njena heterogena svetlost (podobno kot prevarani mozaik ali površinsko srebro).
Električna prevodnost
SI-IF povezuje s svojimi dobro lociranimi elektroni, načeloma se ne strinja s tistim, kar se pričakuje od kovine: morje elektronov, ki "močijo" njihove atome; Vsaj to je tako pri sobni temperaturi.
Ko pa se temperatura poveča, silicij začne poganjati elektriko in se zato obnaša kot kovina; To pomeni, da gre za polprevodniški metaloidni element.
Amorfni silicij
Silicijevi tetrahederji ne sprejemajo vedno strukturnega vzorca, ampak jih je mogoče urejati na neurejen način; In celo, s silikonskimi atomi, katerih hibridizacije so videti SP3 ampak sp2, ki prispeva k nadaljnjemu povečanju stopnje motnje. Zato se govori o amorfnem in nekristalnem siliciju.
V amorfnem siliciju so elektronska prosta delovna mesta, kjer imajo nekateri njihovi atomi orbitalo z elektronom, izginilo. Zahvaljujoč temu lahko sam trdni vodik vodi, kar povzroča nastanek hidrogenalnega amorfnega silicija; to pomeni, da ima si-h povezave, s katerimi se tetraedre zaključijo v neurejenih in poljubnih položajih.
Vam lahko služi: interatomske povezaveTa razdelek se nato zaključi z besedami, da je silicij mogoče predstaviti v treh vrstah trdnih snovi (da ne omenjam njene stopnje čistosti): kristalni, poliristalinski in amorfni.
Vsak od njih ima svojo metodo ali proizvodni postopek, pa tudi svoje aplikacije in dilemo, ko se odloča, za katero od treh je treba uporabiti njihove prednosti in slabosti.
Kje je in dobimo
 Kremenski kristali (silicijev dioksid) so eden glavnih in najbolj izjemnih mineralov, kjer se nahaja silicij. Vir: James St. John (https: // www.Flickr.com/fotografije/jsjgeology/22437758830)
Kremenski kristali (silicijev dioksid) so eden glavnih in najbolj izjemnih mineralov, kjer se nahaja silicij. Vir: James St. John (https: // www.Flickr.com/fotografije/jsjgeology/22437758830) Silicij je sedmi najpomembnejši element vesolja, drugi v Zemljini skorji. Ta element je izjemno povezan s kisikom, ki tvori širok razpon oksidov; Med njimi, silicijev2, in silikati (raznolika kemična sestava).
Silicijev dioksid lahko vidimo s prostim očesom v puščavah in plažah, ker je pesek sestavljen predvsem iz SiO2. Ta oksid se lahko manifestira v nekaj polimorfih, kar je najpogostejše: kremen, ametist, ahat, Christobalite, Tripoli, Coesite, Stishovita in Thundimita. Poleg tega ga lahko najdemo v amorfnih trdnih snovi, kot so Opals in Diatomea Lands.
Silikati so medtem celo strukturno in kemično bogatejši. Med nekaterimi silikati lahko omenimo minerale: azbest (bela, kava in modrikast), feldspar, gline, mycies, olive, aluminosilikati, zeoliti, amfibe in pirokseni.
Praktično so vse kamnine sestavljene iz silicija in kisika, s stabilnimi vezmi Si-O ter njihovi silikati in silikati, pomešani s kovinskimi oksidi in anorganskimi vrstami.
-Zmanjšanje silicijevega dioksida
Težava, ki predstavlja pridobivanje silicija, je prekinitev te povezave Si-O, za katero so potrebne posebne pečice in dobra strategija zmanjšanja. Surovina za ta postopek je kremen v obliki kremena, ki se premika prej, dokler ni fini prah.
Iz tega zemeljskega silicijevega dioksida ga lahko pripravimo bodisi z amorfnim silicijem ali poliristalinom.
Amorfni silicij
V majhnem obsegu, narejenem v laboratoriju in z ustreznimi ukrepi, se silicijev dioksid meša z magnezijevim prahom v talilnem loncu in se oživi v odsotnosti zraka. Takrat poteka naslednja reakcija:
Sio2(s) + mg (s) => 2mgo (s) + da (s)
Magnezij in oksid se izločimo z razredčeno raztopino klorovodikove kisline. Nato preostalo trdno snov obdelamo s fluorhorhorhorsko kislino, tako da zaključi reagiranje sio2 v presežku; V nasprotnem primeru presežek magnezija daje prednost tvorbi njegovega siliciuro, mg2Da, neželena spojina za postopek.
Sio2 Se spremeni v hlapni plin SIF4, ki se povrne za drugo kemično sintezo. Končno se amorfno silicijevo testo posuši pod plinskim vodikovim tokom.
Druga podobna metoda za pridobitev amorfnega silicija je uporaba istega SF4 prej proizvedeni ali sicl4 (prej pridobljeno). Hlapi teh silikonskih halogenurosov se v inertni atmosferi prenašajo čez tekoči natrij, tako da se lahko zmanjšamo plin brez prisotnosti kisika:
Sicl4(g) + 4na (l) => da (s) + 4Nacl (l)
Zanimivo je, da se z amorfnim silicijem izdelujejo sončne plošče z visoko energijsko učinkovitostjo.
Kristalni silicij
Začenši iz kremena ali kremena v prahu, jih odpeljejo v električno ločno pečico, kjer reagira s koksom. Na ta način reducirsko sredstvo ni več kovina, ampak veliko čistost ogljikovega materiala:
Sio2(s) + 2c (s) => da (s) + 2Co (g)
V reakciji se proizvaja tudi silicijev karbid, sic, ki je nevtraliziran s presežkom SIO2 (Spet je kremen pretirano):
2SIC (S) + SIO2(s) => 3Si (s) + 2CO (g)
Druga metoda za pripravo kristalnega silicija je uporaba aluminija kot reducirajočega sredstva:
3SIO2(s) + 4Al (l) => 3Si (s) + 2al2Tudi3(S)
In začenši od kalijevega heksaflurorosilikata, k2[SIF6], tudi reagiramo s kovinskim aluminijem ali kalijem, da povzroči isti izdelek:
K2[SIF6] (l) + 4al (l) => 3Si (s) + 6kf (l) + 4alf3(g)
Takoj se silicij raztopi v staljenem aluminiju, in ko se sistem hladi, se prvi kristalizira in loči od drugega; to pomeni, da so oblikovani silicijevi kristali, ki so videti sivkaste barve.
Poliristalinski silicij
Za razliko od druge sinteze ali produkcij za pridobivanje poliristalinskega silicija se začne s silonsko plinasto fazo, SIH4. Ta plin je podvržen pirolizi nad 500 ° C, tako da se pojavi toplotna razgradnja in s tem njegovih začetnih hlapov na koncu odlagajo silicijeve poliristale na polprevodniški površini.
Naslednja kemična enačba prikazuje reakcijo, ki se zgodi:
Ja h4(g) => da (s) + h2(g)
Očitno v komori ne bi smelo biti kisika, saj bi reagiral s SIH4:
Ja h4(g) + 22(g) => sio2(s) + 2h2O (g)
In spontanost reakcije zgorevanja je takšna, ki se hitro pojavi pri sobni temperaturi na obrazu.
Še ena sintetična pot za izdelavo tega vrst silicijevega dela kristalnega silicija kot surovega materiala. Omogočajo se reagirati z vodikovim kloridom pri temperaturi okoli 300 ° C, tako da nastane triklorosilano:
Vam lahko služi: železo (element): značilnosti, kemična struktura, uporabaDa (s) + 3HCl (g) => sicl3H (g) + h2(g)
In sicl3H reagira na 1100 ° C na regenerirani silicij, zdaj pa poliristalin:
4sicl3H (g) => da (s) + 3Sicl4(g) + 2h2(g)
Dovolj je videti enačbe, da predstavimo predstavo o delu in strogih proizvodnih parametrih, ki jih je treba upoštevati.
Izotopi
Silicij je naravno in predvsem kot izotop 28Da, z obilico 92,23%.
Poleg tega sta še dva izotopa, ki sta stabilna in zato ne trpita radioaktivno razpada: 29Da, z obilico 4,67%; in 30Da, z obilico 3,10%. Biti tako obilen 28Da, ne preseneča, da je atomska teža silicija 28.084 u.
Silicij je lahko tudi v več radioizotopih, med katerimi 31Ja (t1/2= 2,62 ure) in 32Ja (t1/2= 153 let). Drugi (22Ja - 44Če imajo t1/2 zelo kratek ali kratek (manj kot stotine sekund).
Tveganja
Čisti silicij je razmeroma inertna snov, zato se običajno ne kopiči v nobenem organu ali tkivu, dokler je izpostavljenost nizka. V obliki prahu lahko povzroči draženje oči, kar povzroči solze ali rdečico, medtem ko se dotika, lahko povzroči nelagodje kože, srbenje in luščenje.
Ko je izpostavljenost zelo visoka, lahko silicij poškoduje pljuča; Vendar brez poznejših učinkov, razen če je znesek dovolj, da povzroči zadušitev. Vendar se to ne zgodi s kremenčem, ki je povezan z rakom pljuč in boleznimi, kot sta bronhitis in emfizem.
Prav tako je čisti silicij po naravi zelo redek in njegove spojine, tako obilne v zemeljski skorji, ne predstavljajo tveganja za okolje.
Zdaj, glede organov, bi lahko bili strupeni; Vendar so mnogi od njih odvisni od tega, o čem se šteje, pa tudi drugi dejavniki (reaktivnost, pH, mehanizem delovanja itd.).
Prijave
Gradbena industrija
Siliconski minerali vključujejo "kamen", s katerim so zgrajene zgradbe, hiše ali spomenike. Na primer, cementi, beton, štukature in ognjevzdržne opeke so sestavljeni iz trdnih mešanic, ki temeljijo na silikatih. Iz tega pristopa se lahko pojavi uporabnost, ki jo ima ta element v mestih in arhitekturi.
Steklo in keramika
Iz kremena je mogoče izdelati kristale, ki se uporabljajo na optičnih napravah, bodisi kot izolatorji, celice za vzorce spektrofotometrov, piezoelektrične kristale ali zgolj očala.
Tudi, ko je material pripravljen z več aditivi, se na koncu spremeni v amorfno trdno, dobro znano kot steklo; in peščene gore so običajno vir silicijevega dioksida ali kremena, potrebne za njegovo proizvodnjo. Po drugi strani pa se izdelujejo silikati keramični in porcelanski materiali.
Prepletenje idej, silicij je prisoten tudi v obrti in okraskih.
Zlitine
Silicijevi atomi so lahko kohezivni in so mešani s kovinsko matrico, zato je dodatek za številne zlitine ali kovine; Na primer jeklo, za izdelavo magnetnih jeder; Bronze, za izdelavo telefonskih kablov; in aluminij, pri proizvodnji aluminijaste-salicio zlitine za lahke avtomobilske dele.
Zato ga ne moremo najti samo v "kamnu" stavb, ampak tudi v kovinah njihovih stolpcev.
Sušilci
 Želatinezne silicijeve kroglice, ki se uporabljajo kot sušilci. Vir: Osušilci [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Želatinezne silicijeve kroglice, ki se uporabljajo kot sušilci. Vir: Osušilci [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Silicijev dioksid, v obliki gela ali amorfnega.
Elektronska industrija
 Poliristalni in amorfni silicij se uporabljata za proizvodnjo sončnih panelov. Vir: pxhere.
Poliristalni in amorfni silicij se uporabljata za proizvodnjo sončnih panelov. Vir: pxhere. Silicijeve plasti različnih debeline in barv so del računalniških čipov, pa tudi s svojo trdno (kristalno ali amorfno), integrirana vezja in sončne celice so zasnovani.
Ker je polprevodnik, so atomi vključeni z manj (al, b, ga) ali več elektronov (p, as, sb), da ga spremenijo v vrste polprevodnikov str tudi n, oziroma. Z dvema sindikatoma, ena n in drugo str, Izdelane so diode lahkih oddajnikov.
Silikonski polimeri
Znano silikonsko lepilo je sestavljeno iz organskega polimera, ki ga podpira stabilnost verig si-o-si povezav ... če so te verige zelo dolge, kratke ali zakrivljene, lastnosti silikonskega polimera, pa tudi njihove spremembe. Končne aplikacije.
Med njeno uporabo lahko spodaj omenjamo naslednje:
-Lepilo ali lepila, ne le za združevanje papirjev, ampak gradbene bloke, gume, steklene plošče, kamnine itd.
-Maziva v hidravličnih zavornih sistemih
-Okrepi slike in izboljšuje svetlost in intenzivnost njihovih barv, hkrati pa vam omogoča, da se upirate temperaturnim spremembam, ne da bi se razpokali ali avtomobili
-Uporabljajo se kot vodna repelentna razpršila, ki ostanejo suhe nekatere površine ali predmete
-Dajejo osebne higienske izdelke (zobne testenine, šampon, geli, kreme za britvice itd.) Občutek, da je svilnat
-Njeni premazi ščitijo elektronske komponente občutljivih naprav pred toploto in vlago, kot so mikroprocesorji
-S silikonskimi polimeri se več gumijastih kroglic, ki odskočijo, komaj spustijo na tla.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Silicij. Pridobljeno iz: v.Wikipedija.org
- Mikrokemikalije. (s.F.). Kristalografija silicija. Okrevano od: mikrokemikalije.com
- Lentech b.V. (2019). Tabela obdobja: silicij. Okrevano od: Lentech.com
- Marques Miguel. (s.F.). Pojavi se silikon. Okreval od: Nautilus.Fis.UC.Pt
- Bolj hemant. (5. november 2017). Silicij. Okreval od: Hemantmore.org.v
- Pilgaard Michael. (22. avgust 2018). Silicij: pojav, izolacija in sinteza. Okrevano od: Pilgaardelegs.com
- Doktor. Doug Stewart. (2019). Dejstva o silikonskih elementih. Kemikool. Okrevano od: Chemicool.com
- Christiana Honsberg in Stuart Bowden. (2019). Zbirka virov za fotovoltaičnega vzgojitelja. Pvekacija. Pridobljeno iz: pvekacija.org
- Ameriški svet za kemijo, Inc. (2019). Silikoni v vsakdanjem življenju. Okreval od: sehsc.Americachemistry.com

