Lastnosti prodaje haloidov, nomenklatura, kako se oblikujejo, primeri

- 4359
- 863
- Dexter Koch
The haloidne soli So binarne spojine, ki jih tvorita kovina in ne -kometal, brez drugega elementa. Te soli tvorijo reakcijo nevtralizacije med hidratno kislino z osnovo. Na primer: reakcija med klorovodikovo kislino (HCl) z natrijevim hidroksidom (NaOH), da tvori natrijev klorid (NaCl).
Haloidne soli nastanejo tudi z reakcijo hidratacije s kovino. Na primer: magnezijeva reakcija s klorovodikovo kislino, da tvori magnezijev klorid (MGCL2). Kot je razvidno, so kloridi najbolj reprezentativne haloidne soli. Vendar niso edini.
 Halita, natrijev klorid v naravnem stanju, je glavni primer haloidne soli. Vir: http: // gl.Wikipedija.org/w/indeks.Php?Naslov = uporabnik: Shinichi / javna domena
Halita, natrijev klorid v naravnem stanju, je glavni primer haloidne soli. Vir: http: // gl.Wikipedija.org/w/indeks.Php?Naslov = uporabnik: Shinichi / javna domena Haloidne soli po nekaterih definicijah razumejo spojine, ki jih vsebujejo v svoji halogenski strukturi; To je: fluor, klor, bromin in jod, zato veljajo za sinonim za halogene ali halogenuros.
Prav tako znotraj haloidnih soli vključijo nekateri avtorji, spojine, ki jih tvori združitev kovine z elementom, ki uporablja njegovo negativno valenco, vključno z: karbidi, nitridi, fosfuros, sulfidi, seleniuros, arseniuros itd. Te štejejo tudi za haloidne soli, kadar koli so sestavljene iz dveh elementov.
[TOC]
Lastnosti prodaje haloidov
Haloidne soli so skupina spojin, katerih lastnosti je težko vzpostaviti.
Močne ionske povezave
Na splošno so sestavljene iz trdnih snovi z močnimi ionskimi vezmi med ioni dveh elementov: m+X-, kjer m+ ustreza kovinskemu kationu in x- anion, ki izhaja iz ne -metal.
Visoka tališča, vretje in sublimacija
Običajno imajo zelo visoke fuzijske, vrele in sublimacijske točke, prav zaradi sile njegove kristalne strukture.
Lahko vam služi: DAPI (4 ', 6-diamidino-2-fenilindol): značilnosti, temelj, uporabaPrevodnost električne energije
V trdnem stanju so slabi prevodniki električne energije, vendar v vodni raztopini, ko se ionizirajo ali ko se združijo, dobri vozniki postanejo.
Videz
So kristalne trdne snovi, ki lahko ob razdrobljenem prahu postanejo bela obarvanost. Vendar ima veliko haloidnih soli lahko drugačno obarvano. Na primer, nikelj klorid je zelen, medtem ko ima železov klorid nihajno obarvanost med zeleno in rdečo barvo.
Topnost
Večina halurosnih soli je topna v vodi, razen srebra, svinca (ii) in živega srebra (i).
Vonj
Ker niso hlapne spojine, haloidne soli ne predstavljajo močnih vonjav. Tudi zaradi svoje sestave so lahko kisli, slani, grenki ali sladki okusi.
Nomenklatura
Haloidne soli so poimenovane tako, da ime aniona postavijo s pripono Aurohi, sledi neposredno ime kovine, pred njo od. V primeru, da ima kovina več kot eno valenco, je kovina nameščena s pripono medved ali ICO, Odvisno od njegove Valencije.
Ime kovine je mogoče postaviti tudi brez pripona in s številom oksidacije v oklepajih.
Na primer: železni klorid (III) ali železni klorid, FECL3.
Kako tvorijo haloidne soli?
Haloidne soli nastanejo predvsem s tremi reakcijami: nevtralizacija, kislinska reakcija s kovino in reakcija kovine s kovino ali ne -metalnim delovanjem z negativno valenco.
Reakcija nevtralizacije
To je reakcija kisline z osnovo, ki proizvaja sol in molekulo vode. Na primer:
HCl +NaOH → NACl +H2Tudi
Ta primer je bil omenjen princu.
Reakcija kisline s kovino
Močna kislina lahko reagira s kovino, ki izvira iz soli in sproščanje vodika (H2). Na primer: klorovodikova kislina reagira s cinkom (Zn), da tvori cinkov klorid (Zncl2)::
Vam lahko služi: analitična kemijaZn +HCl → Zncl2 + H2
Kombinacija kovine s kovino ali ne -kovino
Te haloidne soli so posledica kombinacije kovine s kovino ali ne -kometa iz halogenov. Na primer: aluminijast fosfuro združuje fosfor z Valencijo -3, z aluminijem z Valencijo +3. Zdaj je ta "kombinacija" posledica specifičnih proizvodnih reakcij za vsako sol.
Uporaba/aplikacije
Kovinski halogenuros
Kovinski halogenuros se uporabljajo v svetilkah z visoko intenzivnostjo, kot so sodobne svetilke. Uporabljajo se tudi v rastlinjakih ali dežnih podnebjih za dopolnjevanje naravne svetlobe. Srebrni halogenidi se uporabljajo v filmih in fotografskih dokumentih.
Kalcijev klorid
 Videz kalcijevega klorida
Videz kalcijevega klorida Kalcijev klorid se uporablja kot vir kalcija pri čiščenju odpadne vode. Uporablja se tudi kot vir kalcija s svojo elektrolizo. Uporablja se pri zdravljenju srčnih aritmij in v primerih hude hipokalcemije.
Železni klorid
Železni klorid se uporablja pri čiščenju odpadne vode in čiščenju vode. Uporablja se tudi za snemanje ali izbiro za baker in posredovanje kot katalizator v procesu sinteze vinil klorida.
Klorid in kalijev bromid
Kalijev klorid se uporablja kot gnojilo in pri zdravljenju hipokalemije ali hipokalemije. Po drugi strani je bil kalijev bromid uporabljen kot antikonvulziven in se trenutno uporablja v farmacevtski industriji in kot preliv.
Klorid in natrijev sulfid
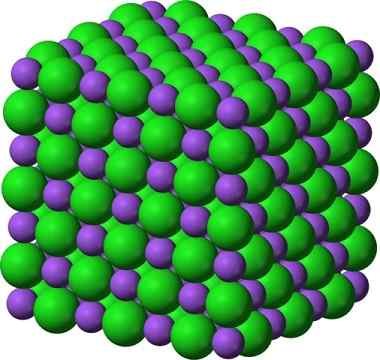
 Kristalna struktura natrijevega klorida, NaCl, tipična ionska spojina. __ vijolične sfere predstavljajo natrijeve katione, Na +in __ zelene sfere predstavljajo ankeji klorid, cl−.
Kristalna struktura natrijevega klorida, NaCl, tipična ionska spojina. __ vijolične sfere predstavljajo natrijeve katione, Na +in __ zelene sfere predstavljajo ankeji klorid, cl−. Natrijev klorid se uporablja kot okus hrane, pri ohranjanju mesa kot antiseptika, v hudi hiponatremiji itd. Natrijev sulfid se uporablja v jedrskih reaktorjih v močni proizvodnji vode, pri izločanju dlak in pri izdelavi gumic, barvil in slik.
Vam lahko služi: aluminijev oksid: struktura, lastnosti, uporabe, nomenklaturaFosfuros in nituros
Aluminijev fosfuro se uporablja kot širok polprevodnik in kot insekticid. Medtem se Gallium nitruro uporablja kot polprevodnik.
Primeri haloidnih soli
Poleg primerov, omenjenih v prejšnjem razdelku, druge haloidne soli z ustreznimi formulami in imeni:
-NaCl: natrijev klorid
-KCL: kalijev klorid
-Cacl2: Kalcijev klorid
-MGCL2: Magnezijev klorid
-CSCL: Cezijev klorid
-Bacl2: Barijev klorid
-FECL2: Železov klorid
-FECL3: Železov klorid
-NICL2: Nikelj klorur
-Cucl: cuprous klorid
-Cucl2: Kupric klorid
-Agcl: srebrni klorid
-Zncl2: Cinkov klorid
-CDCL2: Kadmijev klorid
-HGCL2: Mercuric klorid
-Alcl3: Aluminijev klorid
-NABR: natrijev bromid
-KBR: kalijev bromid
-CSBR: Cezijev bromid
-CDBR: kadmijev bromid
-MGBR2: Magnezijev bromid
-SRBR2: Stroncijev bromid (ii)
-Ki: kalij yoduro
-Nai: natrijev jodid
-CSI: Cesium Yoduro
-Ali3: Aluminijev jodid
-BDP2: Svinčeno jodid (ii)
-NAF: natrijev fluorid
-Lif: litijev fluorid
-Caf2: Kalcijev fluorid
-PTF2: Platinasti fluorid (ii)
-Nas2: Natrijev sulfid
-Li4C: litijev karbid
-Mg2C: magnezijev karbid
-ALP: aluminijast fosfuro
-Ja3N4: Silicijev nitruro
-Kositer: titanium nitruro
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Julián Pérez Porto in María Merino. (2016). Opredelitev haloidnih soli. Opredelitev.od. Obnovi se od: definicija.od
- James P. Birk. (5. junij 2019). Halogenide. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Wikipedija. (2020). Halogenid. Pridobljeno iz: v.Wikipedija.org
- « Lastnosti peroksidov, nomenklatura, uporabe, primeri
- Značilnosti termohigometra, funkcije, deli, uporabe »

