Lastnosti peroksidov, nomenklatura, uporabe, primeri
- 1573
- 228
- Ricky Dach
The peroksidi So vse tiste kemične spojine, ki vsebujejo skupino peroxo, O-O, bodisi kovalentno povezane z ogljikovimi atomi ali drugimi funkcionalnimi skupinami, ali v ionski obliki, kot so anion peroksida, ali22-. Zgoraj je grafično predstavljeno na spodnji sliki. V njem skupina O-O izstopa z modro barvo.
Lahko obstajajo organski peroksidi, kot so diakilperoksidi (r1-O-o-r2), Hidroperoksidi (R-O-O-H), peracidi (RCO-O-O-H) in Peéstres (R1Co-O-O-R2). Imamo tudi anorganske perokside, kot so kovinski peroksidi (mn+Tudi22-) in vodikov peroksid (H-O-H). Slednji je najbolj znan od vseh, ki prejemajo ime vodikovega peroksida.
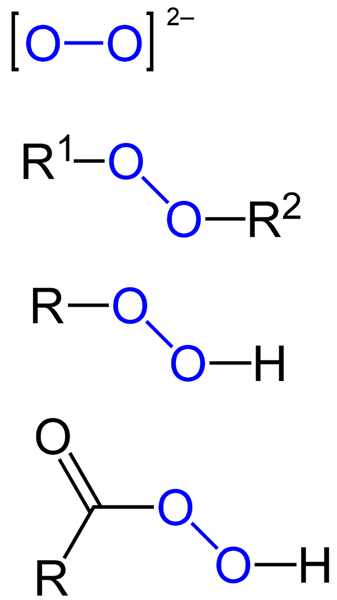 Formule za različne vrste peroksidov, ki obstajajo. Vir: Jü / Public Domain
Formule za različne vrste peroksidov, ki obstajajo. Vir: Jü / Public Domain Vsi peroksidi imajo skupno lastnost zelo reaktivnih, oksidacijskih snovi in v nekaterih primerih eksplozivno. Če jih ni določeno s sintezo, se štejejo za nezaželene in nevarne nečistoče za številne industrijske procese in za laboratorijsko sintezo.
Peroksidi na splošno so odlična oksidacijska sredstva, beljenje, baktericidi in aktivatorji polimerizacij prek tvorbe prostih radikalov. Zato so običajno zelo koristni reagenti ali dodatki v polimerni industriji, pa tudi v živilski industriji za pospešitev oksidacij in odpravo bakterij.
[TOC]
Lastnosti peroksida
Struktura
Peroksidne strukture se osredotočajo na skupino O-O. Vsak atom kisika ima hibridizacijo SP3, Torej povezave -o -ne počivajo v isti ravnini. Na primer, za vodikov peroksid, H-O-H, je kot, ki se tvori med obema H, 115.5., kar kaže, da štirje atomi niso na ravnini.
Izkrivljanja tega in drugih kotov bodo odvisna od identitete drugih molekulskih fragmentov, povezanih s skupino O-O.
Lahko vam služi: Gibbs Free Energy: enote, kako se izračuna, rešijo vajePo drugi strani je mogoče organske in anorganske perokside (razen kovinskih) prepoznati s prostim očesom, če je skupina O-O podrobno opisana v njihovi strukturi, kot sta dva kozarca z "usti". Na ta način je vsak peroksid takoj identificiran z enim pogledom na njegovo strukturo.
Reaktivnost
Povezava O-O je razmeroma šibka v primerjavi z drugimi povezavami, kot sta C-H ali C-O. Zato se ponavadi lomi ali fragnira, da proizvaja visoko reaktivne oksigenirane radikale.
Zaradi teh radikalov so peroksidi razvrščeni kot reaktivne in nevarne snovi, saj lahko poškodujejo tkiva in kakršne koli organske snovi na splošno.
Oksidacijsko delovanje
Peroksidi so močna oksidacijska sredstva, ki si prizadevajo pridobiti elektrone iz okolja, da bi se preoblikovali v vodo, kisik ali hidrokside. Na primer, vodikov peroksid je močnejši oksidantni sredstvo kot isti kalijev permanganat.
To oksidacijsko delovanje se uporablja za njihovo odkrivanje z njihovo reakcijo s železovim sulfatom in kalijevim tiocianatom:
Peroksid +vera2+ + Scn- → Fe (SCN)n(3-N)- (N = 1 do 6).
Kompleks, oblikovan med vero3+ in SCN- Klovno je rdeča, zato opazovanje te barve ustreza pozitivnemu testu za prisotnost peroksidov v vzorcu.
Občutljivost
Peroksidi so snovi, občutljive na visoke temperature in sončno svetlobo. Zato jih je treba shraniti na varnih mestih in znotraj plastičnih in neprozornih zabojnikov, tako da svetloba ne vpliva neposredno nanje.
Nomenklatura
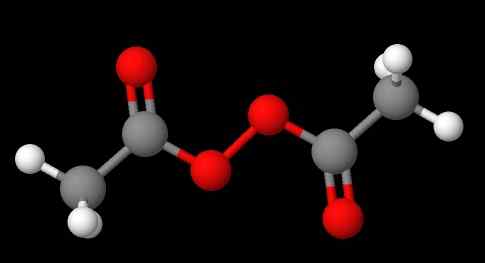
Nomenklatura peroksidov je odvisna od tega, kateri tip spada. Na splošno so mnogi imenovani tako, da omenjajo "peroksid", ki mu sledi substituenti r po abecednem vrstnem redu. Na primer, spojina ch3C (o) ooc (o) ch3 (spodnja slika) se imenuje diacetil ali acetil peroksid, saj ima na vsakem koncu acetilno skupino.
Vam lahko služi: natrijev sulfat (na2SO4): struktura, lastnosti, uporabe, pridobivanje Diacetil peroksid. Vir: Gabriel Bolívar prek Molview.
Diacetil peroksid. Vir: Gabriel Bolívar prek Molview. Spojina c6H5C (o) ooc (o) c6H5 (spodnja slika) po drugi strani se imenuje Dibenzoílo ali benzoílo peroksid iz istih razlogov, navedenih v prejšnjem odstavku.
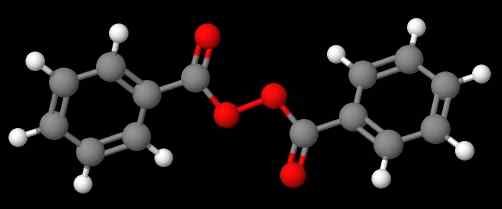 Benzoil peroksid. Vir: Gabriel Bolívar prek Molview.
Benzoil peroksid. Vir: Gabriel Bolívar prek Molview. Medtem, spojina c6H5C (o) ooc (o) ch3 se imenuje acetil benzolelo peroksid. Tokrat se najprej omenja acetilni substituent za začetek s črko 'a'. Drug primer je ch3Pogl2OOC6H5, imenovan etil fenil peroksid.
Podobno nadaljujte s hidroperoksidi. Na primer CHO3OOH se imenuje metil hidroperoksid.
Usposabljanje
Nekatere perokside lahko tvorimo neposredno z izpostavljenostjo zadevne snovi s kisikom zraka, asiranju ali ne s kovinskimi katalizatorji. Prav tako se lahko oblikujejo tako, da snovi izpostavijo ozonu pod določenimi pogoji, pri čemer izvajajo reakcijo ozonolize.
Druga sintetična pot je reakcija vodikovega peroksida z alkilorsulfatom:
R2SW4 + H2Tudi2 → R-O-R +H2SW4
Da bi sintetizirali ali tvorili diahilične perokside ali celo ciklične perokside.
Medtem pa več metod za tvorbo kovinskih peroksidov temelji na oksigeniranju njihovih kovinskih oksidov, tako da "kisik" in izhajajo iz Mo (M (Mn+Tudi2-) ljubezen2 (Mn+Tudi22-).
Peroksidi uporabljajo
Pobudniki polimerizacij
Reakcijskim sredstvim se dodajo peroksidi, zlasti organski peroksidi, za sintezo neskončnosti plastike in materialov, kot so polistiren, silikon, epoksi in akrilne smole, polivinil klorid, vlakna.
To je zato, ker trpijo toplotne razgradnje, da postanejo kisik prosti radikali, kar posledično sproži in katalizira polimerizacije. Zato so zaželene v polimerni industriji.
Lahko vam služi: molarna frakcija: kako je izračunana, primeri, vajeNekateri peroksidi, ki se uporabljajo kot pobudniki, so metil cetona (MEK) peroksid in aceton peroksid.
Belilo in razkužila
Peroksidi so belilna sredstva, ki se uporabljajo za beljenje papirja in moke. So tudi razkužila, popolnoma učinkovita, a agresivna v smislu iztrebljanja bakterij. Klasični primer ustreza vodikovi peroksidu, namenjenem v razredčenih raztopinah (3%) razkuženih ranah.
Oksidacijska sredstva
Peroksidi so tudi oksidacijski povzročitelji, zato najdejo veliko uporab v organski sintezi zelo oksigeniranih snovi.
Viri kisika
Čeprav ni med njegovimi glavnimi uporabi, lahko peroksidi služijo tudi kot viri kisika v nekaterih njihovih razpadih. To je spet pri vodikovem peroksidu.
Primeri peroksidov
Nazadnje bo nekaj primerov peroksidov, bodisi organskih ali anorganskih, s svojimi formulami in ustreznimi imeni:
-H2Tudi2: Vodik ali vodikov peroksid
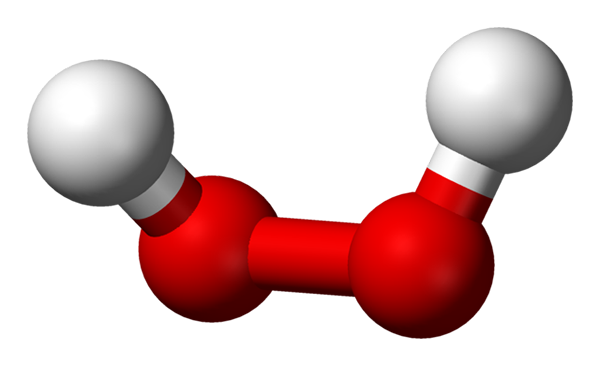 Molekula vodikovega peroksida, predstavljena z modelom kroglic in palic. Vir: Benjah-BMM27 prek Wikipedije.
Molekula vodikovega peroksida, predstavljena z modelom kroglic in palic. Vir: Benjah-BMM27 prek Wikipedije. -Na2Tudi2: natrijev peroksid
-Snop2: barijev peroksid
-C6H5C (pogl3)2Ooh: cummeno hidroperoksid
-(NH4)2S2Tudi8: Amonijev persulfat
- Ho3Sooso3H: peroksidisulfurinska kislina
-(Pogl3)3Cooc (ch3)3: Ditert-butil peroksid
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Organski peroksid. Pridobljeno iz: v.Wikipedija.org
- Elsevier b.V. (2020). Peroksid. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Napredni razvoj kemije. (s.F.). Alkoholi, fenoli in njihovi izvori:
- Pravilo peroksidov C-218. Okrevano od: acdlabs.com
- Vol'nov i.Yo., Petrocelli a.W. (1966) Klasifikacija in nomenklatura anorganskih peroksidnih spojin. V: Petrocelli a.W. (Ur.) Peroksidi, superoksidi in ozonidi alkalijskih in alkalnih zemeljskih kovin. Springer, Boston, MA.
- « Tipičen Baja California Sur za moške in ženske (opis)
- Lastnosti prodaje haloidov, nomenklatura, kako se oblikujejo, primeri »

