Diazonijeve soli

- 1425
- 19
- Don Nitzsche
Pojasnjujemo, kaj so diazonijeve soli, kako se oblikujejo njihove lastnosti in aplikacije
Kaj so diazonijeve soli?
The Diazonijeve soli So organske spojine, v katerih obstajajo ionske interakcije med azo skupino (-N2+) In anion x- (Cl-, F-, Pogl3COO-, itd.). Njegova splošna kemična formula je RN2+X-, In v tem je lahko stranska veriga R dobro alifatska skupina ali arilna skupina; to je aromatični obroč.
Na spodnji sliki je zastopana struktura arediazonijevega iona. Modre sfere ustrezajo azo skupini, črno -bela pa aromatični obroč fenilne skupine. Az+≡N).

Vendar pa obstajajo resonančne strukture, ki to pozitivno obremenijo, na primer v atomu sosednjega dušika: -n = n+. To izvira, ko je nekaj elektronov, ki tvorijo povezavo, usmerjeno v atom dušika na levi.
Prav tako se ta pozitivna obremenitev lahko demociacionira prek PI sistema aromatičnega obroča. Posledično so aromatične diazonijeve soli stabilnejše od alifatskih, saj pozitivna obremenitev ne more demokatirati vzdolž ogljikove verige (ch3, Pogl2Pogl3, itd.).
Usposabljanje
Te soli izhajajo iz reakcije primarne amine s kislo mešanico natrijevega nitrita (nano2).
Sekundarni amini (r2NH) in terciarna (r3N) Drugi dušikovi izdelki, kot so N-nitrozoamin (ki so rumenkasta olja), aminske soli (r3Hn+X-) in n-nitrosonijeve spojine.
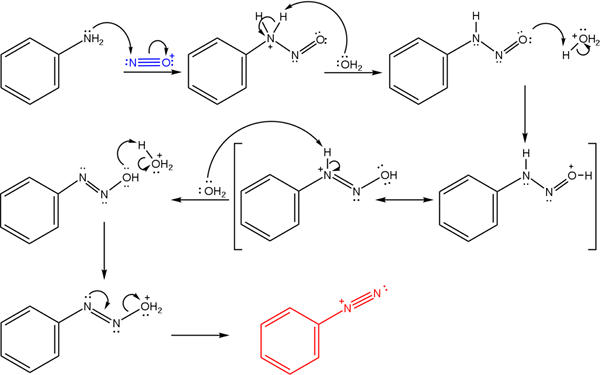
Vrhunska slika ponazarja mehanizem, s katerim ureja tvorba diazonijevih soli ali znana tudi kot reakcija diazotizacije.
Vam lahko služi: Chrome (CR)Reakcija se začne iz fenilamina (AR-NH2), ki izvede nukleofilni napad na atom nitrosonijevega kationa (št+). Ta kation proizvaja nano mešanica2/Hx, kjer je X običajno Cl; to je, hcl.
Nastanek nitrosonijevega kationa sprošča vodo na sredini, ki ugrabi pozitivno obremenjen dušik proton.
Nato ta ista molekula vode (ali druge kisle vrste, ki se razlikujejo od H3Tudi+) dajte proton kisiku, ki demokratizira pozitivno obremenitev manj elektronegativnega dušikovega atoma).
Zdaj je voda spet nezaščitena v dušik, nato pa proizvaja molekulo diazohidroksida (Antepenultimate zaporedja).
Ker je medij kisel, diazohidroksid trpi dehidracijo skupine OH; Za preprečevanje elektronskega prostega delovnega mesta prost navor trojne povezave skupine AZO.
Na ta način na koncu mehanizma bencenodiazonijev klorid ostane v raztopini (c6H5N2+Cl-).
Lastnosti
Na splošno so diazonijeve soli brezbarvne in kristalne, topne in stabilne pri nizkih temperaturah (manj kot 5 ° C).
Nekatere od teh soli so tako občutljive na mehanski vpliv, da jih lahko vsaka fizična manipulacija eksplodira. Končno reagirajo z vodo, da tvorijo fenole.
Reakcije premika
Diazonijeve soli so potencialni molekularni dušik, katerega tvorba je skupni imenovalec reakcij premika. V teh vrstah X izpodriva nestabilno skupino AZO, ki pobegne kot n2(g).
Sandmeyerjeva reakcija
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + Cucn => arcn + n2 + Cu+
Gattermanova reakcija
RNA2+ + Cux => arx + n2 + Cu+
Za razliko od Sandmeyerjeve reakcije ima Gattermanova reakcija namesto halogenida kovinski baker; to pomeni, da se ustvari cux In situ.
Schiemannova reakcija
[RNA2+] Bf4- => Arf + bf3 + N2
Vam lahko služi: ketoni: vrste, lastnosti, nomenklatura, uporabe, primeriZa Schiemannovo reakcijo je značilna toplotna razgradnja benzezonijevega fluoroborata.
Gomberg Bachmannova reakcija
[RNA2+] Cl- + C6H6 => Ar - c6H5 + N2 + Hcl
Drugi premiki
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3Po2 + H2O => c6H6 + N2 + H3Po3 + Hcl
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Žig2 => Arno2 + N2 + Cu+
Redoks reakcije
Diazonijeve soli lahko zmanjšamo na arilhidrazine z mešanico CNCL2/HCl:
RNA2+ => Arnhnh2
Z močnejšim zmanjšanjem z Zn/HCL se lahko zmanjšajo tudi na arilamine:
RNA2+ => Rnah2 + Nh4Cl
Fotokemična razgradnja
[RNA2+] X- => Arx + n2
Diazonijeve soli so občutljive na razgradnjo zaradi pojavnosti ultravijoličnega sevanja ali pri zelo tesnih valovnih dolžinah.
Reakcije AZO
RNA2+ + Ar'h → RNA2Ar ' + h+
Te reakcije so morda najbolj uporabne in vsestranske diazonijeve soli. Te soli so šibki elektrofili (obroč preseli pozitivno obremenitev skupine AZO). Da reagirajo z aromatičnimi spojinami, jih je treba negativno napolniti in tako povzročiti azosove spojine.
Reakcija prehaja z učinkovito zmogljivostjo med pH 5 in 7. Pri kislinskem pH je sklopka nižja, ker protoni skupine azo, zaradi česar napad negativnega obroča nemogoče.
Tudi v osnovnem pH (večji od 10) diazonijeva sol reagira z OH- Za proizvodnjo diazohidroksida, ki je relativno inerten.
Strukture te vrste organskih spojin imajo zelo stabilen konjugiran sistem PI, katerega elektroni absorbirajo in oddajajo sevanje v vidnem spektru.
Posledično je za AZO spojine značilno, da so barvite. Zaradi te lastnosti so jih imenovali tudi azoične barve.
Vam lahko služi: molarnost: koncentracija, enote, izračun, vaje
Vrhunska slika ponazarja koncept sklopke z oranžnico metila kot primera. Sredi svoje strukture lahko opazimo skupino AZO, ki služi kot priključek obeh aromatičnih obročev.
Kateri od obeh obročev je bila elektrofija na začetku sklopke? Tistega na desni, ker skupina sulfonata (-SO3) Odstranite elektronsko gostoto obroča, zaradi česar je še bolj elektrofil.
Prijave

Ena njegovih najbolj komercialnih aplikacij je proizvodnja barvil in pigmentov, ki pokriva tudi tekstilno industrijo v tkaninah. Te azoične spojine so zasidrane na specifična molekularna mesta polimera, umirajo od barv.
Zaradi svoje fotolitične razgradnje se (manj kot prej) uporablja pri reprodukciji dokumentov. Kot? Papirna območja, pokrita s posebno plastiko.
V organski sintezi se uporabljajo kot izhodišča za številne aromatične derivate.
Končno imajo aplikacije na področju pametnih materialov. V teh je površina (na primer zlato) povezana, kar mu omogoča kemični odziv na zunanje fizične dražljaje.

