Osnovna formula soli, lastnosti, nomenklatura, primeri

- 4595
- 644
- Ignacio Barrows
The osnovne soli Vsi so tisti, ki se raztopijo v vodi, ki ustvarjajo rešitve z vrednostmi, večjimi od 7. To pojasnjuje OH ionska tvorba-, ki izhajajo neposredno iz procesa raztapljanja ali ravnotežja hidrolize, kjer sodeluje anion.
Osnovne soli vsebujejo anion OH- V njihovi trdni snovi. Na primer, alkalni hidroksidi, kot so natrij in kalij, NaOH in KOH, veljajo za člane teh soli; Čeprav so izjemno kavstični, zato si zaslužijo poimenovanje hidroksidov, namesto da bi jih imenovali soli.
 Natrijev hidroksid je primer osnovne soli
Natrijev hidroksid je primer osnovne soli Druge osnovne soli imajo namesto tega anione, kot so karbonat, CO32-. Karbonat izhaja iz ogljikove kisline, h2Co3, Šibka kislina. Zato so karbonatne soli, kot je kalcijev karbonat, ki se uporablja pri antacidih, razvrščene kot osnovne soli. Enako sklepanje velja za natrijev bikarbonat, Nahco3, In za vse druge bikarbonatne soli.
Osnovne soli so pomembne, ker jih več pomaga nevtralizirati kislost hrane. Uporabljajo se lahko tudi za pripravo reševalnih rešitev za alkalni pH.
[TOC]
Definicije
Osnovne soli imajo dve definiciji, ki se dopolnjujeta: vsebujejo OH anione- V njihovih trdnih snovmih ali ustvarijo te iste hidroksilne anione, ko se njihovi kristali raztopijo v vodi.
Ne glede na izbrano definicijo bo pH svojih vodnih raztopin večji od 7, zato bodo alkalni ali osnovni.
Splošna formula osnovnih soli
Pojasnjeno, kaj razume z osnovno soljo, je njegova formula, čeprav ne strogo splošna, naslednja:
Mn(OH)WXov
Kjer je m kovinska ali amonijska kation, oh hidroksili in xo anion, ki izhaja iz šibke ali močne kisline. Naročnine n, W in v Koliko M, OH in XO sestavlja osnovno sol, pa tudi njihove deleže.
Upoštevajte to v Lahko je enak nič, kar pomeni, da imamo alkalni ali alkalinoterreo hidroksid. To se zgodi z Naohom in Koh. Podobno, W Lahko je nič, kar pomeni, da ni ionov oh-. Na primer caco3 Nima OH-, Pa vendar ostaja osnovna sol.
Vam lahko služi: kalcijev sulfid (CAS): struktura, lastnosti, pridobivanje, uporabeIz zgoraj navedenega je sklenjeno, da je splošna formula osnovnih soli mn(OH)WXov, Toda vse soli niso v skladu s tem. Zato je pomembnejši dejavnik, ki ga je treba upoštevati narava Xo aniona. Tako bo znano, ko je sol osnovna, ne glede na to, ali ima ione ali ne- V njihovih formulah.
Osnovne lastnosti soli
Osnovne soli se raztopijo v vodi po naslednji enačbi:
Mn(OH)WXov(s) → nM+(AC) + WOh-(AC) + vXo-(AC)
Upoštevajte, da ko raztopi sprošča OH ione- v vodi. To vpliva na pH raztopine in postane alkalen z vrednostjo, večjo od 7. Na primer, osnovni kalcijev nitrat se raztopi v vodi glede na to, kako sledi:
CA (OH) NE3(s) → ca2+(AC) + OH-(ac) + ne3-(AC)
Vrednosti n, W in v Za to sol so enaki 1.
Po drugi strani pa osnovne soli, ki nimajo OH-, Toda anion, pridobljen iz šibke kisline, je hidroliziran v vodi:
Tat3(s) → ca2+(ac) + co32-(AC)
Co32-(Ac) + h2Ali (l) ⇌ hco3-(AC) + OH-(AC)
Upoštevajte, da je produkt te hidrolize oh anion-. Od tam leži alkalnost teh baz. Vendar so, kot je bilo pričakovano, manj osnovni od tistih, ki že imajo ione OH- prisoten v njihovih kristalih. Naoh je na primer izjemno osnovna:
Naoh (s) → NA+(AC) + OH-(AC)
No, sprosti OH ions- neposredno, ko se voda dotakne; Ali še huje, komaj se dotakne vlage kože.
Vam lahko služi: karbokacija: tvorba, značilnosti, vrste, stabilnostDruge fizikalne ali kemijske lastnosti osnovnih soli se ne razlikujejo preveč od lastnosti drugih nevtralnih ali kislih soli.
Nomenklatura
Nomenklatura osnovnih soli je odvisna od narave aniona xo: če je monoatomska ali če je oksoanion. Vendar se bo ta razdelek osredotočil zlasti na osnovne soli z OH anioni-. Tisti, ki jih nimajo, imajo veliko lažje nomenklature, ki si jih zapomnijo ali razlagajo.
Z monoatomskimi anioni
Monoatomski anioni niso predstavljeni kot xo, ampak kot x. Izhajajo iz HX hidraceide, kot so fluoridna kislina, HF ali klorovodikova kislina, HCl in tako naprej.
V teh primerih so sistematično imenovani na dva načina:
(Številčna predpona, razen opice) Hydroxi + anionsko ime, ki se konča s pripono -Uro + ime kovine s svojo valenco v oklepajih (če ima več kot eno)
Na primer, Salt Ni (OH) Cl se imenuje nikelj hidroksiklorid (ii).
Anionsko ime s zaključkom -Uro + -(številka predpona razen opice) hidroksid + kovinsko ime in njegova valenca v oklepajih
Na primer, Salt Ni (OH) CL lahko poimenujemo tudi kot nikelj klorid-hidroksid (II).
Imamo tudi tradicionalno nomenklaturo, včasih pomešano s sistematičnim:
Anionsko ime, ki mu sledi (številka predpona razen opice) osnovno in ime kovine s priponki -Ooso ali -ico, kot je uporabljeno.
Na primer, Ni (OH) CL se imenuje nikelj osnovni klorid ali osnovni nikelj klorid (ii).
Z oksoanioni
Sistematična nomenklatura za osnovne soli, ki imajo oksoanije, je nekoliko bolj zapletena. Vendar je najpreprostejša različica zgrajena na naslednji način:
(Številčna predpona) hidroksid- (anionsko ime) + od + kovinskega imena in njene valencije v oklepajih
Na primer vera (oh) ne3 se imenuje: hidroksidno-železni nitrat (ii).
Ima tudi tradicionalno nomenklaturo:
Osnovni Nion + (številčna predpona) ime + kovinsko ime, ki se konča v -so ali -ico
Vam lahko služi: kisik: lastnosti, struktura, tveganja, uporabeTako vera (oh) ne3 Imenuje se: železov osnovni nitrat ali osnovni železni nitrat (ii).
Usposabljanje
Osnovne soli so produkt nevtralizacij kisline baze, zlasti med hidrato ali oksocidom s presežkom baze ali hidroksida:
Osnova (presežek) + kislina → osnovna sol ali alkalna + voda
Na primer ca (OH) ne3 Nastaja z nevtralizacijo dušikove kisline s presežkom kalcijevega hidroksida:
CA (OH)2(Presežek) + hno3 → CA (OH) NE3 + H2Tudi
Druga ustanovitev usposabljanja bi bila naslednja:
Vera (OH)3(Presežek) + H2SW4 → fe (OH) Torej4 + 2H2Tudi
Ta sol se imenuje: osnovni železov sulfat, osnovni železni sulfat (III) ali železni hidroksid-sulfat (III).
Primeri osnovnih soli
 Antacidi, kot so kalcijev karbonat, Caco3, so primeri osnovnih soli. Vir: Pixabay.
Antacidi, kot so kalcijev karbonat, Caco3, so primeri osnovnih soli. Vir: Pixabay. Nazadnje bo nekaj drugih primerov osnovnih soli navedeno skupaj z njihovimi preprostejšimi imeni:
-Nach3COO: natrijev acetat
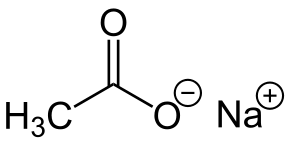 Natrijev acetat
Natrijev acetat -Na2S: natrijev sulfid
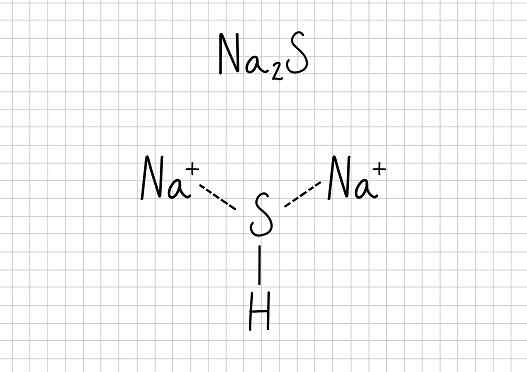 Natrijev sulfid
Natrijev sulfid -KCN: kalijev cianid
-MGCO3: magnezijev karbonat
-Vera (OH) Torej3: Osnovni železni sulfit (iii)
-Vera (oh) (c6H5COO)2: Osnovni železni benzoat (iii)
-Aucl (OH)2: Zlati dibasični klorid (iii)
-Cuclo3(OH): Osnovni bakreni klorat (ii)
-Na (OH) Torej4: Osnovni aluminijev sulfat
-PB (OH)2Co3: Dibasični svinčeni karbonat (iv)
Težava osnovnih soli je, da ni mogoče pripraviti vseh, ker presežek baze ali hidroksida ni dovolj, da bi jih kristalizirali, ne da bi se zatekli k drugim procesom. To je primer PB (OH)2Co3. Vendar ta karbonat obstaja kot beli svinčev (II) pigment, katerega formula je 2pbco3· PB (OH)2 ali pb3(OH)2(Co3)2.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Alkalna sol. Pridobljeno iz: v.Wikipedija.org
- Wu c., Dowell c. & Hooper n. (1. julij 2014). Kislinske lastnosti soli. Okrevano od: kem.Librettexts.org
- Nicola McDougal. (2020). Kisle in osnovne solinske rešitve: Pojasnilo in primer. Študij. Okrevano od: študij.com
- Problem in kemične vaje. (s.F.). Osnovne soli. Okrevano od: akorral.je

