Značilnosti in primeri Exergonic Reakcije

- 3314
- 865
- Ignacio Barrows
A Exergonična reakcija To je tisti, ki se pojavi spontano in na splošno spremlja sproščanje energije, bodisi v obliki toplote, svetlobe ali zvoka. Ko se toplota sprosti, se reče, da se soočamo z eksotermično in eksergonsko reakcijo.
Zato sta 'eksotermični' in 'eksorski' izrazi zmedeni, saj se napačno obravnavajo kot sinonimi. To je zato, ker so tudi številne eksotermične reakcije Exergonic. Če torej opazimo velik odvajanje toplote in svetlobe, na primer izvor ognja.
 Izgorevanje lesa je primer eksotermične in hkrati eksponične reakcije. Vir: Pixnio.
Izgorevanje lesa je primer eksotermične in hkrati eksponične reakcije. Vir: Pixnio. Vendar lahko sproščena energija ostane neopaženo in ne bo tako presenetljiva. Na primer, tekoči medij se lahko rahlo segreje in še vedno posledica Exergonic Reaction. V nekaterih eksponičnih reakcijah, ki prehajajo prepočasi, najnižjega zvišanja temperature sploh ni opaziti.
Osrednja in značilna točka te vrste termodinamičnih reakcij je zmanjšanje GIBBS brez energije v produktih glede na reagente, kar pomeni spontanost.
[TOC]
Značilnosti Exergonic Reakcije
Splošni diagram
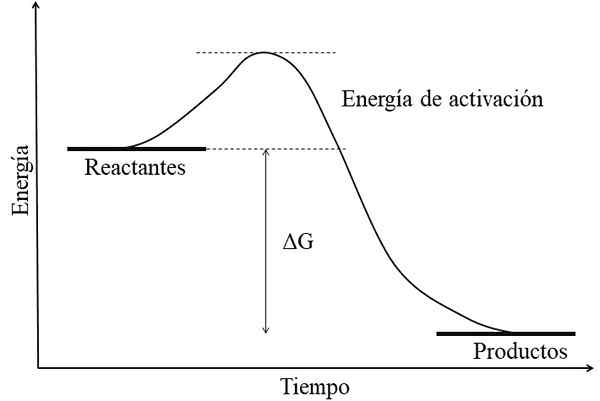 Energetski diagram za Exergonic Reaction. Vir: Gabriel Bolívar.
Energetski diagram za Exergonic Reaction. Vir: Gabriel Bolívar. Glavna značilnost exergonične reakcije je, da imajo produkti proste energije GIBS -. To dejstvo je običajno povezano z izdelki, kemično bolj stabilni, z močnejšimi povezavami, bolj dinamičnimi strukturami ali bolj "udobnimi" pogoji.
Zato je ta energetska razlika, ΔG, negativna (ΔG < 0). Al ser negativa, la reacción en teoría debe ser espontánea. Sin embargo, otros factores también definen dicha espontaneidad, como lo son la energía de activación (la altura de la colina), la temperatura, y los cambios de entalpía y entropía.
Vam lahko služi: homogeni sistemVse te spremenljivke, ki se odzivajo na naravo pojava ali obravnavane kemijske reakcije. In tudi videti bo, da ni nujno, da je eksotermična reakcija.
Ko je aktivacijska energija zelo velika, reaktanti potrebujejo pomoč katalizatorja za zmanjšanje omenjene energijske ovire. Zato obstajajo Exergonic Reakcije, ki se dajejo z zelo nizkimi hitrostmi ali se sploh ne pojavljajo.
Prosto zmanjšanje energije v sistemu
Naslednji matematični izraz zajema tisto, kar je komentirano zgoraj:
ΔG = ΔH - TΔS
Izraz ΔH je pozitiven, če gre za endotermično reakcijo in negativen, če je eksotermičen. Če želimo, da je ΔG negativen, mora biti izraz TΔS zelo velik in pozitiven, tako da je pri odštevanju ΔH rezultat operacije tudi negativen.
Zato in to je še ena posebna značilnost Exergonic Reakcije: pomenijo veliko spremembo v sistemski entropiji.
Tako smo lahko ob upoštevanju vseh izrazov prisotni pred Exergonic Reaction, a hkrati endotermični; torej z ΔH pozitivno, zelo visoko temperaturo ali spremembo velike entropije.
Večina eksponičnih reakcij je tudi eksotermičnih, ker če je ΔH negativen, in s odštevanjem drugega še bolj negativnega izraza bomo imeli ΔG z negativno vrednostjo; Razen če se TΔS ni negativen (entropija se spušča), zato bi eksotermična reakcija postala endogonska (ne spontana).
Pomembno je poudariti, da je spontanost reakcije (ne glede na to, ali je Exergonic ali ne) močno odvisna od termodinamičnih pogojev; Medtem ko je hitrost, s katero prehaja, je posledica kinetičnih dejavnikov.
Lahko vam služi: živa snov: koncept, značilnosti in primeriSpontanost eksorgonske reakcije
Kar je bilo rečeno. Na primer, spojina se lahko raztopi v vodi, ki jo ohladi skupaj s svojo posodo. Ta postopek raztapljanja je endotermičen, ko pa se zgodi spontano.
Eksotermična reakcija
Obstajajo "bolj eksonične" reakcije kot drugi. Če želite izvedeti, bi moral biti naslednji izraz:
ΔG = ΔH - TΔS
Najbolj eksonične reakcije so tiste, ki se spontano dajejo vsem temperaturam. Torej ne glede na vrednost t v prejšnjem izrazu je ΔH negativen in ΔS pozitiven (ΔH 0). Zato so zelo eksotermične reakcije, kar ne nasprotuje začetni ideji.
Obstajajo lahko tudi eksotermične reakcije, kjer se entropija sistema zmanjšuje (ΔS < 0); tal como sucede en la síntesis de macromoléculas o polímeros. En este caso, son reacciones exergónicas solamente a bajas temperaturas, ya que de lo contrario el término TΔS sería muy grande y negativo.
Endotermična reakcija
Po drugi strani obstajajo reakcije, ki so spontane le pri visokih temperaturah: kadar je ΔH pozitiven in ΔS pozitiven (ΔH> 0 in ΔS> 0). Govorimo o endotermičnih reakcijah. Zato se lahko temperaturne spuste pojavijo spontano, ker imajo povečanje entropije.
Medtem obstajajo reakcije, ki sploh niso exergonične: kadar imata ΔH in ΔS pozitivne vrednosti. V tem primeru, ne glede na temperaturo, reakcija ne bo nikoli spontano. Takrat se pogovarjamo o končni reakciji.
Vam lahko služi: faza razprševanjaPrimeri eksegonskih reakcij
Za kemijo je običajno značilno, da je eksploziven in briljanten, zato se domneva, da je večina reakcij eksotermična in eksorgonska.
Izgorenje
Exergonične reakcije so izgorevanje alkanov, olefinov, aromatičnih ogljikovodikov, sladkorjev itd.
Kovinski oksidaksi
Prav tako so oksidacije kovin eksorne, čeprav minejo počasneje.
Katabolične reakcije organizma
Vendar pa obstajajo tudi drugi bolj subtilni procesi, ki so tudi eksponični in zelo pomembni: katabolične reakcije našega presnove. Tu makromolekule razgradijo, ki delujejo kot rezervoarji za energijo, se sproščajo v vročini in ATP, in zahvaljujoč temu, da telo opravlja številne svoje funkcije.
Najbolj emblematičen od teh reakcij je celično dihanje, nasprotno fotosintezi, kjer se ogljikovi hidrati s kisikom "zgorejo", da jih spremenijo v majhne molekule (CO2 in h2O) in energija.
Drugi
Med drugimi exergoničnimi reakcijami imamo eksplozivno razgradnjo dušikovega triayoduro, ali3; dodajanje vodnih alkalnih kovin, ki ji sledi eksplozija; polimerna sinteza etoksiliranih smol; kislinske nevtralizacije v vodni raztopini; in luminescentne kemo reakcije.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Walter J. Moore. (1963). Fizikalna kemija. V kemični kinetiki. Četrta izdaja, Longmans.
- Iran. Levine. (2009). Načela fizikalnokemije. Šesta izdaja, stran 479-540. MC Graw Hill.
- Wikipedija. (2020). Exergonična reakcija. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (16. septembra 2019). Endergonična in Exergonska reakcija in proces. Okreval od: Thoughtco.com
- Exergonic Reakcija: definicija in primer. (18. september 2015). Okrevano od: študij.com
- Akademija Khan. (2018). Brezplačna energija. Okrevano od: je.Khanacademy.org
- « Mehanske energijske formule, koncept, vrste, primeri, vaje
- Trajnostna poraba za to, kar je uporaba, pomen, dejanja, primeri »

