Značilnosti himotripsa, struktura, funkcije, mehanizem delovanja
- 1142
- 180
- Roman Schamberger
The Chimotripsin Je drugi najpogostejši prebavni protein s strani trebušne slinavke proti tankemu črevesju. Je encim, ki pripada družini serin-protej in je specializiran za hidrolizo peptidnih vezi med aminokislinami, kot so tirozin, fenilalanin, triptofan, metoda in levkin, ki so prisotni v velikih beljakovinah.
Ime "hemotripsin", pravzaprav združuje skupino encimov, ki jih proizvaja trebušna slinavka, in ki aktivno sodelujejo pri črevesni prebavi beljakovin pri živalih. Beseda izhaja iz dejanja Renin, ki ga ima ta encim o vsebnosti želodca ali "chimo".
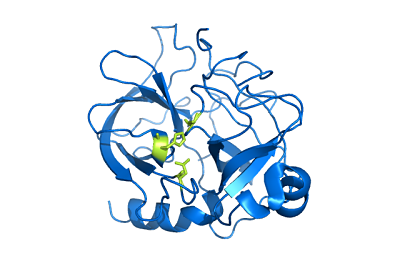
 Chimotripsin Struktura (vir: uporabnik: Mattyjenjen [Atribucija] prek Wikimedia Commons)
Chimotripsin Struktura (vir: uporabnik: Mattyjenjen [Atribucija] prek Wikimedia Commons) Čeprav ni natančno znano, kako široka je njegova porazdelitev v živalskem kraljestvu, velja, da so ti encimi prisotni vsaj pri vseh jagnjetih in obstajajo poročila o njihovi prisotnosti v "bolj primitivnih robovih", kot so členopodi in artropodi in tisti Celestroads.
Pri tistih živalih, ki imajo trebušno slinavko, je tak organ glavno mesto proizvodnje kimotripsa, pa tudi drugih proteaz, encimskih zaviralcev in predhodnikov ali zimogenov.
Himotripsi so najbolj preučeni in bolje značilni encimi, ne le v zvezi z njihovo biosintezo, temveč tudi z njihovo aktivacijo iz Zimogena, njene encimske lastnosti, inhibicijo, kinetično in katalitično lastnosti ter njegovo splošno strukturo.
[TOC]
Značilnosti in struktura
Himotripsi so endopeptidaze, to je proteaze, ki hidrolizirajo peptidne vezi aminokislin v "notranjih" položajih drugih beljakovin; Čeprav se je tudi pokazalo, da lahko hidrolizirajo estre, amidas in arilmidas, čeprav z manj selektivnosti.
Imajo povprečno molekulsko maso približno 25 kDa (245 aminokislin) in se proizvajajo iz predhodnikov, ki so znani kot kemotripsinogeni.
Iz trebušne slinavke so očiščeni dve vrsti kemotripsinogenov, A in B. V prašič modelu je bil opisan tretji hemotripsinogen, opisan himotripsinogen c. Vsak od teh treh zimogenov je odgovoren za proizvodnjo himotropsinov A, B in C.
Lahko vam služi: Quintana Roo Flora in FaunaHimotripsin A tvorijo tri polipeptidne verige, ki so kovalentno povezane med seboj prek mostov ali disulfidnih vezi med ostanki cisteina. Vendar je pomembno omeniti, da mnogi avtorji menijo, da je monomerni encim (sestavljen iz ene same podenote).
Te verige sestavljajo strukturo, ki ima elipsoidno obliko, v kateri so skupine, ki imajo elektromagnetne obremenitve, nameščene proti površini (razen aminokislin, ki sodelujejo v katalitičnih funkcijah).
Na splošno so himotropsi izredno aktivni za kislinsko pH, čeprav so tisti, ki so bili opisani in očiščeni iz žuželk in drugih živali, ki niso razvrednotene.
Funkcije hemotripsa
Ko se eksokrina trebušna slinavka stimulira, bodisi s hormoni bodisi z električnimi impulzi, ta organ sprosti sekretorna zrnca, bogata s kemotripsinogenom, ki nekoč doseže tanko črevo, razreže še ena proteaza med odpadki 15 in 16, nato Popolnoma aktiven protein.
Morda je glavna funkcija tega encima, da deluje v skladu z drugimi izločenimi proteazami proti prebavi za prebavo ali razgradnjo beljakovin, porabljenih s hrano.
Izdelki takšne proteolize pozneje služijo kot vir ogljika in energije z aminokislinskim katabolizmom ali pa jih je mogoče "reciklirati" neposredno za nastanek novih celičnih beljakovin, ki bodo izvajali več in raznolike funkcije na fiziološki ravni.
Mehanizem delovanja
Himotripsi izvajajo svoja dejanja šele po aktiviranju, saj se ti nastajajo kot "predhodniki" (zimogen), imenovane kemotropsinogene.
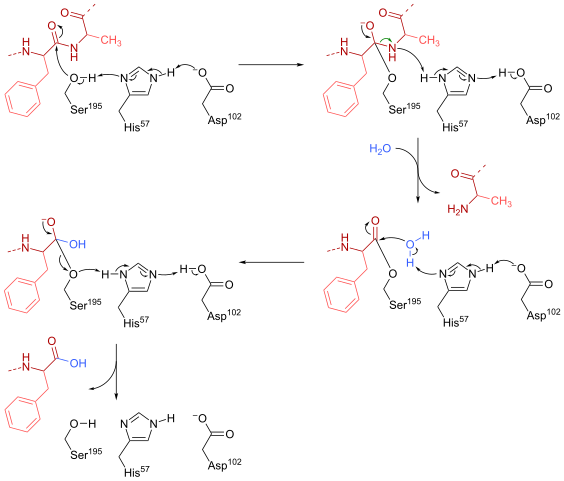 Quimotripsin reakcijski mehanizem (vir: HBF878 [CC0] prek Wikimedia Commons)
Quimotripsin reakcijski mehanizem (vir: HBF878 [CC0] prek Wikimedia Commons) Usposabljanje
Zimogene himotripsina sintetizirajo akinarne celice trebušne slinavke, po katerih se migrirajo iz endoplazemskega retikula v Golgijev kompleks.
Vam lahko služi: znanosti, ki so povezane z biologijoTe zrnce se kopičijo na koncih acinosov in se sproščajo kot odgovor na hormonske dražljaje ali živčne impulze.
Aktivacija
Glede na pogoje aktivacije je mogoče najti več vrst himotripsinov, vendar vse pomenijo proteolitični "rez" peptidne povezave v zimogenu, himotripsinogen, proces, ki ga katalizira encim tripsin.
Aktivacijska reakcija je sprva sestavljena iz rezalne vezi med aminokislinami 15 in 16 himotripsinogena, ki tvori π-kvalifin, ki je sposoben "samoproces" in popolne aktivacije avtokatalize.
Delovanje tega zadnjega encima spodbuja tvorbo po peptidih skupaj s pomočjo C-terminalne verige, ki se začne z ostanki 149).
Deli, ki ustrezajo odpadkom 14-15 in 147-148 (dva dipéptida), nimajo katalitičnih funkcij in se ločijo od glavne strukture.
Katalitična aktivnost
Himotripsin je odgovoren za hidrolizirajoče peptidne vezi, pretežno pa napade karboksilni del aminokislin, ki imajo aromatične lateralne skupine, to so aminokisline, kot so tirozin, triptofan in fenilalanin.
Serin (195) znotraj aktivnega mesta (Gly-Asp-series-gly-glu-ala-val) te vrste encimov je morda najpomembnejši ostanek za njegovo delovanje. Reakcijski mehanizem je naslednji:
- Himotripsin sprva najdemo v obliki "brez substrata", kjer katalitična "triada" sestavlja stranska karboksilna skupina aspartatskega ostanka (102), imidazol obroč histidin ostankov (57) in skupinski hidroksil serin (195).
- Substrat se sreča z encimom in se pridruži temu, da tvori tipičen encim-substratno reverzibilni kompleks (po micaelijskem modelu), kjer katalitična "triada" olajša nukleofilno napad z aktiviranjem hidroksilne skupine serina.
Lahko vam služi: baze dušika: kaj so, klasifikacija, funkcije- Ključna točka reakcijskega mehanizma je v tvorbi delne povezave, kar ima za posledico polarizacijo hidroksilne skupine, ki zadostuje za pospešitev reakcije.
- Po nukleofilnem napadu karboksilna skupina postane tetraedrski posrednik oksianov, ki ga stabilizirata dva vodikova mostova, ki jih tvorita skupina N in H ostankov GLY 193 in 195.
- Oxyanion je spontano "preurejanje" in nastane encimski posrednik, na katerega je bila dodana acilna skupina (aciled encim).
- Reakcija se nadaljuje z vstopom molekule vode na aktivno mesto, molekulo, ki spodbuja nov nukleofilni napad, ki ima za posledico nastanek drugega tetraedrskega posrednika, ki ga tudi stabilizirajo vodikovi mostovi.
- Reakcija se konča, ko je ta drugi posrednik ponovno preurejen in spet tvori encim-substratni micaelijski kompleks, kjer aktivno mesto encima zaseda izdelek, ki ga vsebuje karboksilna skupina.
Reference
- Appel, w. (1986). Chimotripsin: molekularne in katalitične lastnosti. Klinična biokemija, 19 (6), 317–322.
- Bender, m. L., Killheffer, j. V., & Cohen, s. (1973). Chimotripsin. CRC kritični pregledi v biokemiji, 1 (2), 149-199.
- Udarec, d. M. (1971). 6 Struktura kimotripsina. V encimih (vol. 3, str. 185-212). Akademski tisk.
- Udarec, d. M. (1976). Struktura in mehanizem kimotripsina. Računi kemijskih raziskav, 9 (4), 145-152.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehningerjeva načela biokemije. Macmillan.
- Polgár, l. (2013). Katalitični mehanizmi peptidov serina in treonina. V priročniku proteolitičnih encimov (PP. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hipoteza za mehanizem delovanja kimotripsina. Zbornik Nacionalne akademije Združenih držav Amerike, 43 (11), 969.
- « Sinteza benzilne kisline, prenos in uporabe
- Značilnosti vizualnega učenja, strategije, dejavnosti, primeri »

