Periodične lastnosti elementov in njihove značilnosti

- 2486
- 582
- Cary Goyette
The Periodične lastnosti elementov So tisti, ki svoje fizično in kemično vedenje definirajo z atomskega vidika in katerih veličini poleg atomskega števila omogočajo klasifikacijo atomov.
Od vseh lastnosti so te značilne, kot že ime pove, ker so periodične; To pomeni, da če je periodična tabela preučena, je mogoče potrditi, da njegove velikosti ubogajo trend, ki sovpada in se ponavlja z ureditvijo elementov v obdobjih (vrsticah) in skupinah (stolpci).
 Notranja periodičnost dela elementov periodične tabele. Vir: Gabriel Bolívar.
Notranja periodičnost dela elementov periodične tabele. Vir: Gabriel Bolívar. Na primer, če potujete ob periodičnem obdobju in se lastnost z vsakim elementom zmanjšuje, se bo to zgodilo v vseh obdobjih. Po drugi strani pa, če se spustite po skupini ali stolpcu, poveča svojo velikost, enako lahko pričakujemo za druge skupine.
In tako se njihove različice ponavljajo in dokazujejo preprost trend, ki se strinja z ureditvijo elementov za njihovo atomsko število. Te lastnosti so neposredno odgovorne za kovinsko ali ne -metalno naravo elementov, pa tudi na njihove reaktivnosti, ki so jim pomagale razvrstiti z večjo globino.
Če za trenutek ni bila znana identiteta elementov in jih je bilo videti kot čudne "sfere", bi lahko obnovili periodično tabelo (z veliko dela), ki bi uporabili te lastnosti.
Na ta način bi domnevne sfere pridobile barve, ki bi jim omogočile, da se med seboj razlikujejo v skupinah (vrhunska slika). Če poznajo njihove elektronske značilnosti, bi se lahko organizirale v obdobjih, skupine pa bi izdale tiste, ki imajo enako število valenčnih elektronov.
Učenje in sklepanje periodičnih lastnosti je enako vedeti, zakaj elementi reagirajo tako ali drugače; Vemo, zakaj so kovinski elementi v določenih regijah tabele, in ne -metalni elementi v drugem.
[TOC]
Katere so periodične lastnosti in njihove značilnosti
-Atomski radio
Pri opazovanju slikovnih sfer je prva stvar, ki jo je mogoče opaziti, da niso vsi enake velikosti. Nekateri so bolj zajetni kot drugi. Če jih opazimo z večjimi podrobnostmi, bo ugotovljeno, da se te velikosti razlikujejo za upoštevanje vzorca: v obdobju se v obdobju zmanjšuje od leve proti desni, v skupini pa se poveča od zgoraj navzdol.
Na zgoraj navedeno lahko rečemo tudi na ta način: atomski polmer se zmanjšuje proti skupinam ali stolpcem desne in se v spodnjih obdobjih ali vrsticah poveča. Tako je atomski polmer prva periodična lastnost, saj njegove razlike sledijo vzorcu znotraj elementov.
Jedrska obremenitev v primerjavi z elektroni
Kakšen je ta vzorec? V obdobju atomski elektroni zasedajo isto energijsko raven, ki je povezana z razdaljo, ki jih loči od jedra. Ko se premaknemo iz ene skupine v drugo (kar je enako kot potovanje v obdobje v desno), jedro doda elektrone in protone znotraj iste energijske ravni.
Vam lahko služi: ogljikZato elektroni ne morejo zasesti razdalj dalje od jedra, kar povečuje njegovo pozitivno obremenitev, ker ima več protonov. Posledično imajo elektroni večjo privlačnost do jedra in jih vedno bolj pritegnejo, ko se število protonov povečuje.
Zato imajo elementi na desnem koncu periodične tabele (rumeni in turkizni stolpci) manjše atomske radijske sprejemnike.
Po drugi strani pa, ko "skoči" iz enega obdobja v drugo (kar je enako, če se skupina spusti), nova omogočena raven energije omogoča, da elektroni zasedejo bolj oddaljene prostore v jedru. Ker je jedro (z več protoni) privlači manj sile; In atomski radijski sprejemniki se zato povečujejo.
Ionski radijski sprejemniki
Ionski radijski sprejemniki ubogajo vzorec, podoben vzorcu atomskih radijskih sprejemnikov; Vendar ti niso toliko odvisni od jedra, toda koliko elektronov ali manj ima atom glede na njegovo nevtralno stanje.
Kationi (na+, AC2+, Do3+, Biti2+, Vera3+) imajo pozitivno obremenitev, ker so izgubili enega ali več elektronov, zato jih jedro privabi z večjo silo, saj je med njimi manj odbojnosti. Rezultat: Kationi so manjši od atomov, iz katerih izhajajo.
In za anione (oz2-, F-, S2-, Yo-) Nasprotno, imajo negativno obremenitev, ker ima enega ali več presežnih elektronov, med seboj povečujeta odbojnosti med privlačnostjo, ki jo ima jedro. Rezultat: Anioni so večji od atomov, iz katerih izhajajo (nižja slika).
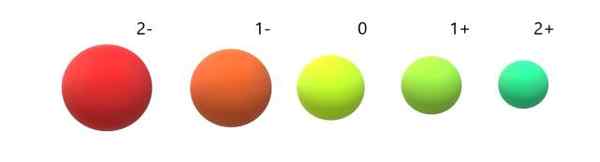 Sprememba ionskih radijskih sprejemnikov glede na nevtralni atom. Vir: Gabriel Bolívar.
Sprememba ionskih radijskih sprejemnikov glede na nevtralni atom. Vir: Gabriel Bolívar. Vidimo, da je Anion 2- najbolj obsežen od vseh, kation 2+. Radijski sprejemniki se povečajo, ko je atom negativno nabit, in se sklene, ko je pozitivno zaračunan.
-Elektronegativnost
Ko imajo elementi majhne atomske radijske sprejemnike, ne privlačijo le njihovih elektronov, ampak tudi elektrone sosednjih atomov, ko tvori kemično vez. Ta težnja po privabljanju elektronov drugih atomov znotraj spojine je tisto, kar je znano kot elektronegativnost.
Tisti, ki je majhen, še ne pomeni, da bo bolj elektronegativen. Če je tako, bi bili helij in vodikov elementi najbolj elektronegativni atomi. Helij do mesta, kjer je pokazala znanost, ne tvori kovalentne povezave; In vodik, komaj ima en sam proton v jedru.
Vam lahko služi: bakreni sulfid: struktura, lastnosti, uporabeKadar so atomski radijski sprejemniki veliki, jedra nimajo dovolj moči, da bi pritegnili elektrone drugih atomov; Zato so najbolj elektronegativni elementi tisti z majhnim atomskim polmerom in večjim številom protonov.
Spet so tisti, ki odlično izpolnjujejo te značilnosti, nemetalni elementi p bloka periodične tabele; To so tisti, ki pripadajo skupini 16 ali kisiku (O, S, SE, TE, PO) ter skupini 17 ali fluori.
Trend
Glede na vse, kar je rečeno, so najbolj elektronegativni elementi še posebej nameščeni v zgornjem desnem kotu periodične tabele; imeti fluorid kot element, ki vodi seznam najbolj elektronegativa.
Ker? Ne da bi se zatekli na lestvice elektronegativnosti (Pauling, Mulliken itd.), fluoror, čeprav je večji od neona (plemenit plin v obdobju), prvi lahko tvori povezave, drugi pa ne. Poleg tega ima jedro za majhno velikost veliko protonov, in kjer je fluor, bo dipolski trenutek.
-Kovinski značaj
Če ima element atomski polmer v primerjavi s tistimi iz istega obdobja in je tudi malo elektronegativen, je potem kovina in ima visok kovinski značaj.
Če se vrnemo na glavno sliko, rdečkasta in zelenkasta krogla, prav tako siva, ustrezajo kovinskim elementom. Kovine imajo edinstvene značilnosti in od tu se začnejo prepletati periodične lastnosti s fizikalnimi in makroskopskimi lastnostmi snovi.
Za elemente z visokim kovinskim značajem so značilni njihovi razmeroma veliki atomi, ki jih je enostavno izgubiti elektrone, saj jih jedra komajda pritegnejo k njim.
Kot rezultat, zlahka oksidirajo ali izgubijo elektrone, da tvorijo katione, m+; To ne pomeni, da so vsi kationi kovinski.
Trend
Na tej točki lahko predvidite, kako se kovinski značaj v periodični tabeli razlikuje. Če je znano, da imajo kovine velike kovinske radijske sprejemnike in da je tudi malo elektronegativov, je treba pričakovati najtežje elemente (nižja obdobja), najbolj kovinski; in lažji elementi (zgornja obdobja), najmanj kovinski.
Prav tako se kovinski značaj zmanjšuje, bolj elektronegativen je element. To pomeni, da bo gostovanje obdobij in skupin desno od periodične tabele v svojih višjih obdobjih doseglo najmanj kovinske elemente.
Zato se kovinski značaj poveča s spuščanjem skupine in se v istem obdobju zmanjšuje v desno v desno. Med kovinskimi elementi imamo: na (natrij), li (litij), mg (magnezij), ba (barij), ag (srebro), au (zlato), PO (Polonio), PB (svinec), CD (kadmij) ), Do (aluminij) itd.
Vam lahko služi: vrelišče: koncept, izračun in primeri-Ionizacijska energija
Če ima atom velik atomski polmer, se pričakuje, da njegovo jedro ne ohranja elektronov v precejšnji moči v najbolj odmevnih plasteh. Posledično njihovo odpravo iz atoma v plinski fazi (individualizirano) ne bo zahtevalo veliko energije; To je ionizacijska energija, ei, potrebna za odvzem elektrona.
Prav tako je enako, da je energija, ki jo je treba zagotoviti, da bi premagali silo privlačnosti jedra atoma ali plinskega iona na njegovem najbolj oddaljenem elektronu. Manjši je atom in bolj elektronegativen, nižji je; To je vaša težnja.
Naslednja enačba prikazuje primer:
Na (g) => na+(g) + e-
Potrebno za dosego tega ni tako veliko v primerjavi z drugo ionizacijo:
Na+(g) => na2+(g) + e-
Saj v Na+ Prevladujejo pozitivne naboje in ion je manjši od nevtralnega atoma. Posledično jedro Na+ pritegne z veliko večjo silo za elektrone, zato zahteva veliko večjega.
-Elektronska afiniteta
In končno obstaja periodična lastnost elektronske afinitete. To je energetski trend, ki ima atom plinske fazne elementa za sprejemanje elektrona. Če je atom majhen in ima jedro z veliko privlačnostjo, vam bo enostavno sprejeti elektron, ki tvori stabilen anion.
Bolj kot je stabilen anion glede na njegov nevtralni atom, večja je elektronska afiniteta. Vendar pa se začnejo igrati tudi odbojnosti med istimi elektroni.
Na primer dušik ima večjo elektronsko afiniteto kot kisik. To je zato, ker so njihovi trije elektroni 2p izginili in se med seboj manj odbijajo in dohodni elektron; Medtem ko je v kisiku, obstaja par seznanjenih elektronov, ki izvajajo večjo elektronsko odbojnost; In v fluoridu sta dva para.
Zaradi tega naj bi bil trend elektronskih afinitet normaliziran iz tretjega obdobja periodične tabele.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Prof. Ortega Graciela m. (1. april 2014). Periodične lastnosti elementov. ABC barva. Pridobljeno iz: ABC.com.Py
- Kemija librettexts. (7. junij 2017). Obdobje lastnosti elementov. Okrevano od: kem.Librettexts.org
- Čelada, Anne Marie, ph.D. (2. januar 2019). Periodične lastnosti elementov. Okreval od: Thoughtco.com
- Toppr. (s.F.). Obdobje lastnosti elementov. Okrevano od: toppr.com /
- Periodične lastnosti elementov: Potovanje čez mizo je potovanje skozi kemijo. [PDF]. Obnovljeno od: COD.Edu
- « Zastarelost zaznani dejavniki, posledice in primeri
- Objektivna umetniška zgodovina, značilnosti, predstavniki in dela »

