Značilnosti prolina, struktura, funkcije, hrana
- 4473
- 30
- Cary Goyette
The Prolin (Pro, p) spada v 22 aminokislin, ki so razvrščene kot osnovne. To je neobčutljiva aminokislina, saj jo lahko sintetizira človek in druge živali sesalcev.
Leta 1900 je nemški znanstvenik Richard Willstatter prvi izvlekel in opazoval prolin. Vendar je leta 1901 Emili Fischer skoval izraz "prolin", ki temelji na pirolidinskem obroču aminokisline; To raziskovalcu je uspelo podrobno razložiti sintezo prolina iz mlečnega kazeina.
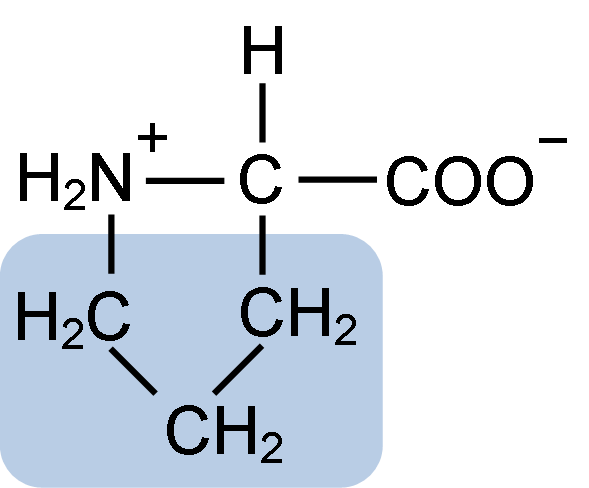
 Kemična struktura proline aminokisline (vir: klavecin [CC by-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Kemična struktura proline aminokisline (vir: klavecin [CC by-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Pri beljakovinah, kot je kazein. V tem proteinu se prolin porazdeli homogeno v celotni strukturi in se povezuje z β kazeinom in proteinom αS1; Poleg tega preprečuje okvarjene strukturne zanke ali zlaganje.
V biokemijskih analizah, ki se trenutno uporabljajo za določanje natančnega zaporedja aminokislin, ki sestavljajo beljakovine.
Scurvy je morda najbolj znana bolezen, povezana s prolino. To je povezano s pomanjkanjem vnosa vitamina C, kar neposredno vpliva.
[TOC]
Značilnosti
Sekundarna amino skupina α z ogljikom otežuje nalogo klasifikacije prolina nekoliko otežena. Vendar je v nekaterih besedilih to razvrščeno poleg razvejanih aminokislin ali z alifatskimi stranskimi verigami, saj je stranska veriga ali r r prolina hidrofobna ali alifatska.
Ena najpomembnejših značilnosti prolina je, da v nobenem primeru ne more nastati vodikovih mostov, zaradi česar je idealen za strukturiranje zapletenih in zapletenih zavojev v terciarnih strukturah beljakovin.
Tako kot imajo vse aminokisline dve izoformi, ki sta odvisna od osrednjega ogljikovega atoma, tudi prolin lahko najdemo v naravi, kot je L-prolin ali kot D-prolol. Vendar je oblika L-prolina najpogostejša narava in je tista, ki je del beljakovinskih struktur.
V beljakovinah, kjer se nahaja, prolin pogosto zaseda kraje blizu površine ali pregib ali "obračanje" polipeptidne verige, saj toga in zaprta struktura prolina otežuje močno interakcijo z drugimi aminokislinskimi interakcijami.
Struktura
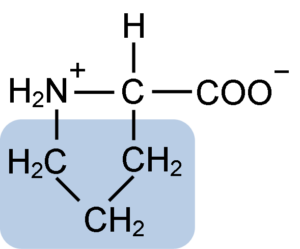
Prolin ima posebno strukturo med osnovnimi aminokislinami, saj predstavlja amino skupino (NH2) sekundarno in ne primarno amino skupino, ki je značilna za vse aminokisline.
Skupina R ali bočna veriga prolina je obroč pirolidin ali tetrahidropirol. To skupino tvori heterociklični amin (brez dvojnih vezi) petih ogljikovih atomov, kjer je vsaka od njih nasičena z vodikovimi atomi.
Prolin ima posebnost, da je "osrednji" atom ogljika vključen v heterociklični pirolidinski obroč, zato sta edini "prosti" ali "izjemni" atomi karboksilna skupina (COOH) in vodikov atom (h) heterocikličnega obroča aminokislina.
Vam lahko služi: superoksid dismutaza: značilnosti, struktura, funkcijeMolekularna formula prolina je C5H9NO2, njegovo ime IUPAC. Ima približno molekulsko maso 115,13 g/mol, njegova pogostost videza pri beljakovinah pa je približno 7%.
Funkcije
Kolagenska in tropokolagenska vlakna so najpogostejša beljakovine pri večini živali z vretenčarji. Ti sestavljajo kožo, tetive, kostno matrico in številna druga tkiva.
Kolagena vlakna so sestavljena iz številnih trojnih polipeptidnih sprožilcev, ki so sestavljeni iz več ostankov prolina in glicina v zaporedju glicin-praksolin-prolin-prolin/hidroksiprolin (slednji je spremenjen derivat prolina).
V svoji izvorni obliki je prolin del prokolagena, ki je predhodnik polipeptidov kolagena in nekaterih drugih beljakovin vezivnega tkiva. Encim prolin hidroksilaza.
Kakšna je glavna funkcija prolina v kolagenskih vlaknih?
Hidroksiprolin daje značilnosti odpornosti kolagena, saj ima ta derivat aminokislin možnost oblikovanja velikega števila vodikovih mostov med verigami trojnih propelerjev, ki sestavljajo beljakovine.
Encimi, ki katalizirajo hidroksilacijo prolinskih odpadkov, zahtevajo prisotnost vitamina C (askorbinska kislina) in, kot že omenjeno, je skorbut posledica oslabitve kolagenskih vlaken zaradi okvare hidroksilacije prelivnih odpadkov, kar povzroča zmanjšanje, kar povzroča zmanjšanje v zmanjševanju v Vodikovi mostovi, ki vzdržujejo kolagena vlakna.
Druge funkcije
Prolin je nepogrešljiv za tvorbo pregibov in beljakovinskih zavojev.
Njegova zaprta struktura otežuje to aminokislino, poleg tega je težko "sprejeti" znotraj beljakovin, saj ne more tvoriti vodikovih mostov, da bi "komunicirali" z drugimi bližnjimi odpadki, povzroči nastanek "zavojev" ali "zavojev" vzdolž strukture beljakovin kjer se nahaja.
Vsi beljakovini s kratkim življenjskim časom imajo vsaj regijo z obilnim ponavljajočim se prolinom, glutamatom, serinom in treoninom. Te regije segajo od 12 do 60 odpadkov in se imenujejo sekvence škodljivcev.
Beljakovine, ki vsebujejo zaporedje škodljivcev.
Biosinteza
Številne aminokisline je mogoče sintetizirati iz glikoliznih posrednikov, pentoznega fosfata ali cikla citronske kisline (KREBS cikel). Prolin in arginin nastaneta na kratkih poteh glutamata.
Skoraj pogosta biosintetska pot za vse žive organizme se začne s pretvorbo L-glutamata v γ-L-glutamil-5-fosfat, zahvaljujoč delovanju encima glutamata-5-nivoja (v bakterijah) ali z γ-glutamil- Whinas (pri ljudeh).
Ta reakcija pomeni fosforilacijo, odvisno od ATP, zato se poleg glavnega izdelka ustvari tudi molekula ADP.
Reakcija, katalizirana z glutamat 5-mormidno dehidrogenazo (v bakterijah) ali z γ-glutamil reduktaznim fosfatom (pri ljudeh) pretvori γ-L-glutamil-5-fosfat v L-glutamat-glutamat-5-simidsko prisotnost Co -faktor NADPH.
Vam lahko služi: Half Stuart: fundacija, priprava in uporabaL-glutamato-5-semialdehid je reverzibilen in spontano dehidriran na (S) -1-1-Pyrrool), v katerih je potrebna tudi molekula NADPH ali NADH.
Degradacija
Prolin, arginin, glutamin in histidin se nenehno razgradijo na α-Zetoglutarat, da vstopijo v cikel cikcije citronske kisline ali Krebsa. V posebnem primeru prolina to najprej oksidira encim prolin oksidaze v pirrolin-5-karboksilat.
V prvem koraku, kjer pride do oksidacije prolina v pirrolin-5-karboksilat, se samostojni protoni sprejmejo z E-FAD, ki se zmanjša na E-FADH2; Ta korak je ekskluziven za prolinsko aminokislino.
Zaradi spontane reakcije se pirrolin-5-karboksilat pretvori v γ-semialdehid glutamat, ki nato služi kot substrat za encim glutamat γ-mamid. V tem koraku se pojavita dva protona, enega od njih sprejme NAD, ki je zmanjšan na NADH, drugi pa v obliki h+.
Arginin, tako kot prolin, se pretvori v γ-semialdehid glutamat, vendar skozi nadomestno presnovno pot, v kateri sodelujeta dva različna encima.
Encim γ-semialdehid glutamat dehidrogenaza pretvori glutamat γ-semialdehid v L-glutamat. Nato ta L-glutamat ponovno oksidira z encimskim glutamatom dehidrogenazo, ki končno tvori α-Zetoglutarat, ki bo vgrajen v cikel citronske kisline.
V oksidacijskem prehodu glutamata se sprosti proton (H+) in amino skupina (NH3+). Proton zmanjšuje skupino NADP+ in izvira molekula NADPH.
Kljub številnim podobnostim med razgradnjo in biosintezo poti prolina in arginina se te aminokisline sintetizirajo in razgradijo s popolnoma nasprotnimi potmi, ki uporabljajo različne encime, različne kofaktorje in se pojavljajo različne znotrajcelične razdelke.
Živila, bogata z Valino
Na splošno imajo vsa živila z visoko vsebnostjo beljakovin velike količine prolina. Med njimi so meso, mleko, jajca in drugi. Ko pa je naše telo v optimalnem stanju zdravja in prehrane, lahko sintetizira prolinsko endogeno.
Prolin je mogoče najti tudi v številnih stročnicah in oreščkih ter v polnozrnatih žitarih, kot je ovsena kaša, na primer. Druga prolinska hrana so pšenični otrobi, oreščki, mandlji, grah, fižol, med drugim.
Nekatere naturistične zaloge običajno oblikujejo stisnjene iz aminokislin L-lizina in L-prololina skupaj, da bi ljudem pomagali s težavami s sklepi ali odložiti staranje tkiv.
Vendar pa zagotovo ni dokazano, da zaužitje prehranskih dodatkov teh aminokislin pomembno vpliva.
Prednosti vašega vnosa
Diete, bogate s prolinom, se običajno predpisujejo za ljudi, ki imajo bolezni sklepov, kot so artritis, razpade, lomljenje ligamentov, dislokacije, tendonitis in drugi, in to je posledica njihovega odnosa s sintezo kolagenskih vlaken, prisotnih v telesnih vezivnih tkivih.
Vam lahko služi: agar m.R.S: Kaj je, temelj, priprava, uporabljaŠtevilni farmakološki losjoni in tablete, ki se uporabljajo v estetski industriji raztrganine, razjede in opekline.
V prehrambeni industriji obstajajo beljakovine, ki imajo "bioaktivne peptide", ki izvajajo vadbo, ki presega njihove prehranske lastnosti. Ti peptidi imajo na splošno dva do devet aminokislinskih odpadkov, med katerimi prolin, arginin in lizin obiluje.
Ti bioaktivni peptidi imajo lahko antihipertenzivno aktivnost z določenim opioidnim učinkom; Lahko delujejo kot imunomodulatorji s spodbujanjem imunskega odziva proti nekaterim patogenom in lahko celo povzročijo povečanje vazoaktivnosti, kar izboljša obtok tistih, ki jih uživajo.
Motnje pomanjkanja
Gluten je beljakovine, ki so prisotni v zrnih pšenice, ki povzroča črevesno vnetje. Ljudje, ki trpijo zaradi "intolerance glutena", so znani kot "celiakijski" bolniki in znano je, da je ta protein bogat s prolinom in glutaminom, katerih proteolitična razgradnja je za ljudi s tako stanjem težka.
Nekatere bolezni so povezane s slabim zlaganjem pomembnih beljakovin in zelo pogosto je, da so te napake povezane z izomerizacijo Cis-trans amida povezav v prolinskih odpadkih, saj za razliko od drugih peptidnih povezav, v katerih je izomer trans Je zelo naklonjen, v prolinu je prikrajšan.
Pri prolinskih odpadkih je bilo ugotovljeno, da obstaja velika težnja po tvorbi izomera Cis najprej kot izomer trans V sosednjih amidih za prolinske odpadke, ki lahko ustvarijo "napačno" konformacijo beljakovin.
Presnovne motnje
Tako kot pri drugih bistvenih in nepomembnih aminokislinah je treba tudi glavne patološke motnje, povezane s prolinom.
Na primer, hiperprolinemija je značilen primer pomanjkanja enega od encimov, ki sodelujejo v prolinski razgradnji, zlasti v 1-pirolin-5-karboksilat dehidrogenazi.
To patologijo običajno diagnosticiramo z visoko vsebnostjo prolina v krvni plazmi in prisotnost presnove 1-pirololina-5-karboksilata v urinu prizadetih bolnikov.
Glavni simptomi te bolezni so sestavljeni iz nevroloških motenj, bolezni ledvic in izgube slušne sposobnosti ali gluhosti. Drugi težji primeri vključujejo hudo duševno zamudo in izrazite psihomotorne težave.
Reference
- Abu-Baker, s. (2015). Pregled biokemije: pojmi in povezave
- Delauney, a. J., & Verma, D. Str. S. (1993). Prolin biosinteza in osmoregulacija v rastlinah. The Plant Journal, 4 (2), 215-223.
- Seznam, b., Lerner, r. Do., & Barbas, c. F. (2000). Neposredne asimetrične aldolske reakcije, katalizirane s prolinom. Journal of American Chemical Society, 122 (10), 2395-2396
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehningerjeva načela biokemije. Macmillan.
- Plimmer, r. H. Do. (1912). Kemična ustava beljakovin (vol. 1). Longmans, zelena.
- Szabados, l., & Savouré,. (2010). Prolin: večnamenska aminokislina. Trendi v rastlinskih znanosti, 15 (2), 89–97.

