Značilnosti tiptofana, struktura, funkcije, prednosti
- 4719
- 1511
- Ricky Dach
On Triptophan (TRP, W) je aminokislina, razvrščena v skupino esencialnih aminokislin, saj ga človeški organizem ne more sintetizirati in ga mora pridobiti s prehrano.
Nekatera živila, kot so mleko in njihovi derivati, meso, jajca in nekatera žita, kot sta kvinoja in soja.
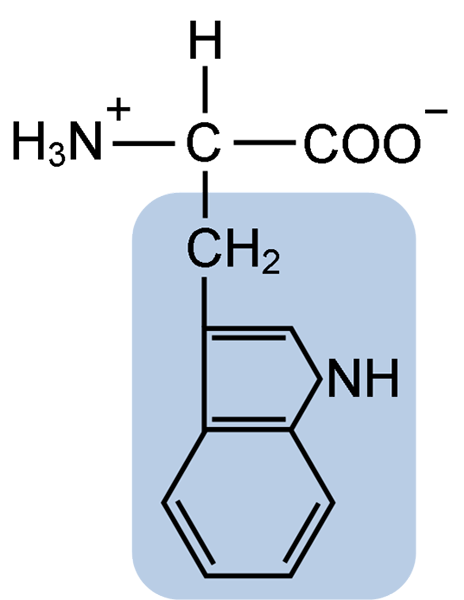
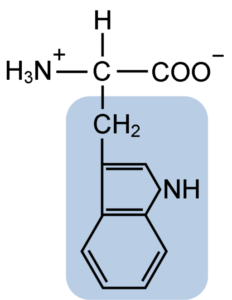 Kemična struktura tiptofanske aminokisline (vir: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Kemična struktura tiptofanske aminokisline (vir: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) V naravi je znanih več kot 300 različnih aminokislin in le 22 predstavlja monomerne enote celičnih beljakovin. Med slednjimi je 9 bistvenih aminokislin, vključno s triptofanom, vendar se bistvenost vsake razlikuje med eno vrsto in drugo.
Triptofan ima različne funkcije, med katerimi je njihova udeležba v sintezi beljakovin, v sintezi serotonina, ki je močan vazokonstriktor in nevrotransmiter, melatonin in v sintezi so -untaž Nad.
V rastlinskem kraljestvu je triptofan temeljni predhodnik rastlinskega hormona, znanega kot avksin (Indole-3-ocetna kislina). Lahko sintetizirajo nekatere bakterije, kot so In. coli Iz korizmato, ki nastane iz nekaterih glikolitičnih derivatov, kot sta fosfoenolpiruvat in eritrosa-4-fosfat.
Njegova razgradnja pri sesalcih se pojavi v jetrih, kjer se uporablja za sintezo acetil koencima A (acetil-CoA), zato je opisana kot aminokislina klica glukogena, saj lahko vstopi v cikel tvorbe glukoze.
Poročali so o različnih študijah s spornimi rezultati, povezanimi z uporabo triptofana kot prehranskega dodatka za zdravljenje nekaterih patologij, kot so depresija in nekatere motnje spanja.
Obstajajo nekatere bolezni, povezane s prirojenimi napakami pri presnovi aminokislin. V primeru tiptofana lahko zaradi triptofana -2,3 -monoksigenaze, recesivne dedne bolezni, za katero so značilne duševne zaostalosti in spremembe kožnega tipa pelagra.
[TOC]
Značilnosti
Skupaj s fenilalaninom in tirozinom najdemo triptofan v skupini aromatičnih in hidrofobnih aminokislin.
Vendar pa je za triptofana od aromatične stranske verige, ki ima polarne skupine, rahlo hidrofobna aminokislina, zmanjšuje to hidrofobnost.
Za kombinirane obroče imajo močno absorpcijo svetlobe v območju spektra blizu ultravijoličnega in ta značilnost se pogosto uporablja za strukturno analizo beljakovin.
Absorbira ultravijolično svetlobo (med 250 in 290 nm) in čeprav ta aminokislina ni zelo obilna v strukturi večine beljakovin človeškega telesa, njegova prisotnost predstavlja pomemben prispevek za sposobnost absorpcije svetlobe v območju območja območja 280 nm večine beljakovin.
Dnevne zahteve triptofana se razlikujejo od starosti. Pri dojenčkih med 4 in 6 meseci je povprečna zahteva približno 17 mg na kilogram teže na dan; Pri otrocih, starih od 10 do 12 let, je 3,3 mg na kilogram teže na dan, pri odraslih pa 3,5 mg na kilogram teže na dan.
Triptofan se absorbira s črevesno potjo in je hkrati ketogena in glikogena aminokislina.
Ker gre za predhodnik serotonina, pomemben nevrotransmiter, mora triptofan doseči centralni živčni sistem (CNS) in za to mora prečkati krvno možgansko pregrado, za katero obstaja specifičen aktivni transportni mehanizem.
Vam lahko služi: Biggy Agar: fundacija, priprava in uporabaStruktura
Triptophan ima molekularno formulo C11H12N2O2 in ta esencialna aminokislina ima aromatično stransko verigo.
Tako kot vse aminokisline ima tudi triptofan atom ogljika, pritrjen na amino skupino (NH2), atom vodika (H), karboksilno skupino (COOH) in stransko verigo (r), ki jo tvori heterociklična struktura, skupina indol.
Njegovo kemijsko ime je 2-amino-3-propionska kislina, ima molekulsko maso 204,23 g/mol. Njegova topnost pri 20 ° C je 1,06 g v 100 g vode in ima gostoto 1,34 g/cm3.
Funkcije
Pri človeku se triptofan uporablja za sintezo beljakovin in je nepogrešljiv za tvorbo serotonina (5-hidroksitriptamin) močnega vazokonstriktorja, ki spodbuja kontrakcijo gladkih mišic (zlasti v majhnem črevesju) in nevrotransmiter in urejajo tesnobo.
Triptophan je predhodnik sinteze melatonina in zato ima posledice v ciklih spanja in budnosti.
Omenjena aminokislina se uporablja kot predhodnik na enega od treh načinov za nastajanje kofaktorja NAD, zelo pomembnega kofaktorja, ki sodeluje v različnih encimskih reakcijah, povezanih z dogodki redukcije oksida.
Triptofan in nekateri njegovi predhodniki se uporabljajo za nastanek vegetacijskega hormona, imenovanega avksin (kislina indol-3-aktivna kislina). Auksini so rastlinski hormoni, ki uravnavajo rast, razvoj in številne druge fiziološke funkcije rastlin.
Biosinteza
V organizmih, ki jih lahko sintetizirajo, ogljikovo okostje triptofana izhaja iz fosfoenolpiruvata in eritrosa-4-fosfata. Te so nastale iz posrednika Krebsovega cikla: Oxalacetat.
Fosfoenolpiruvat in erih-4-fosfat se uporabljata za sintezo korizma na sedem encimskih poti. Fosfoenolpiruvat (PEP) je produkt glikolize in erih-4-fosfata pentozne fosfatne poti.
Kako je pot sinteze korizta?
Prvi korak simptomov korizmata je združitev PEP z eritrozo-4-fosfatom, da tvori 2-Zo-3-disoxxi-d-anabino-heptulosonato-7-fosfat (DAHP) (DAHP) (DAHP).
To reakcijo katalizira encim 2-Zo-3-dexxi-D-Anabino-heptulosonato-7-fosfat sintaza (DAHP sintaza), ki jo zavira korizta.
Druga reakcija pomeni ciklacijo DAHP s sintazo dehidrohinat, encimom, ki zahteva kofaktor NAD, ki se med to reakcijo zmanjša; Posledično se pojavi 5-dišidrokinat.
Tretji korak te poti pomeni izločanje molekule vode 5-dehidrokvinata, reakcije, ki jo katalizira encim dehidratazni dehidrohinat, katerega končni izdelek ustreza 5-dishydro Shikimato.
Keto skupina te molekule je zmanjšana na hidroksilno skupino in posledično se oblikuje Shikimato. Encim, ki katalizira to reakcijo, je odvisna od NADPH.
Peti korak poti pomeni tvorbo 5-fosfatne shikimate in porabo molekule ATP z encimom, znanim kot kinaza shikimato, zadolžena za fosforilacijo Shikimata v položaju 5.
Kasneje iz 5-fosfatnega Shikimata in z delovanjem 3-Enlappiruvil Shikimato-5-fosfat sintaze 3-Enlappiruvil Shikimato 5-fosfat nastane. Zgoraj omenjeni encim spodbuja premik fosforilne skupine druge molekule s hidroksilno skupino ogljika v položaju 5 5-fosfata Shikimate.
Lahko vam služi: zakaj je pomembno skrbeti za biotsko raznovrstnost?Sedma in zadnja reakcija katalizira s sintaznim korizmom, ki odpravlja fosfat iz 3-enlapata Shikimate 5-fosfata in naredi korizmata.
V glivi N. Crassa, En sam večnamenski encimski kompleks katalizira pet od sedmih reakcij te poti in ta kompleks se doda še trije encimi, ki na koncu ustvarijo triptofan.
Sinteza triptofana v bakterijah
V In. coli, Triptofan korizem transformacija vključuje pet dodatnih encimskih poti:
Prvič, encim antranilata sintaze pretvori koristat v antranilat. V tej reakciji sodeluje molekula glutamina, ki jo je podarila amino skupina, ki se veže na indol obroč triptofana in postane glutamat.
Drugi korak katalizira fosforibozil transferaza antranilat. V tej reakciji se molekula pirofosfata 5-fosforribosil-1-pirofosfat (PRPP) (PRPP) premika z energijo, nastane pa N- (5'-fosforibosil).
Tretja reakcija te poti triptofana pomeni sodelovanje encima fosforibosil-izomeraze. Tu je n- (5'-foribosil) -santranilat.
Kasneje se indol-3-glicerol fosfat tvori v reakciji, ki jo katalizira simpatična sintaza indol-3-glicerola, kjer se sproščata molekula CO2 in H2O in 1- (O-karboksifenilamin) -1-desoxyribulosa 5-fosfat.
Zadnja reakcija te poti se konča, ko tvori triptofan, ko kataliz triptofan sintaze.
Degradacija
Pri sesalcih se triptofan razgradi v jetrih do acetil-coa na poti, ki vključuje dvanajst encimskih korakov: osem do doseganja α-zo-stoatraatata in še 4, da pretvori α-zo-dotadipato v acetil koencim do.
Vrstni red razgradnje, dokler α-cetoadapato ni:
Tiptofan → N-Quinurenin formil → Quinurenin → 3-hidroksi kinurenin → 3-hidroksi-antranilat → ε-semialdehid 2-amino-3-muconcycix veliko → → → → amino α-amino sluznico amouz.
Encimi, ki katalizirajo te reakcije, so:
Tiptofan 2-3-dioksigenaza, formamidaza kinurenin, NADPH-odvisna monooksigenaza Nadph-odvisna.
Ko se ustvari α-cethoadipat, se oksidativna dekarboksilacija tvori gluteral-CoA. To z ß-oksidacijo, glutaconil-CoA oblika, ki izgubi atom ogljika v bikarbonatu (HCO3-), osvoji molekulo vode in se konča kot Crotonil-CoA.
Crotonil-CoA, tudi za ß-oksidacijo, prinaša acetil-CoA. Omenjeni acetil-CoA lahko sledi več načinov, med katerimi glukoneogeneza, da tvori glukozo in cikel Krebs, po potrebi tvori ATP.
Vendar pa lahko to molekulo usmerimo tudi k tvorbi ketonskih teles, ki jih je mogoče končno uporabiti kot vir energije.
Živila, bogata s triptofanom
Rdeče meso na splošno, piščanec in ribe (zlasti modre ribe, kot sta losos in tuna) so še posebej bogate s triptofanom. Mleko in njegovi derivati, jajca, zlasti rumenjak, so tudi živila z veliko vsebnosti triptofana.
Druga živila, ki služijo kot naravni vir te aminokisline, so:
- Oreščki, kot so oreščki, mandlji, pistacije in anakardo, med drugim.
- Riževa žita.
- Suha zrna, kot so fižol, leča, čičerika, soja, kvinoja itd.
- Pivski kvas in svež fižol, banane in banane, ananas ali Ananá, avokado, slive, vodna kreša, brokoli, špinača in čokolada.
Lahko vam služi: podmorniški morski pes: zgodovina, resničnost ali fikcija?Prednosti vašega vnosa
Poraba tiptofana je nujno potrebna za sintezo vseh beljakovin, ki ga vključujejo v svojo strukturo, in s svojimi različnimi funkcijami omogoča uravnavanje razpoloženja, ciklov spanja in budnosti ter najrazličnejših biokemijskih procesov, v katerih sodeluje NAD.
Poleg znanih učinkov na razpoloženje serotonin (izpeljan s triptofanom) posega v več kognitivnih funkcij, povezanih z učenjem in spominom, ki so torej povezane tudi s triptofanom.
Obstajajo podatki, ki prikazujejo razmerje med razpoloženjem, serotoninskim in prebavnim osi kot sistemom dvosmernih vplivov med možganskimi čustvenimi in kognitivnimi središči ter perifernim delovanjem prebavnega trakta.
Uporaba kot prehransko dopolnilo za zdravljenje nekaterih motenj, zlasti tistih, povezanih s centralnim živčnim sistemom, je bil zelo sporen, ker njegov konkurenčni prevoz z nevtralnimi aminokislinami, veliko bolj obilen, otežuje doseganje pomembnega in trajnega povečanja triptofana po after njegova ustna administracija.
Kljub tem polemikam je bila njegova uporaba postavljena kot dodatek v:
- Zdravljenje bolečine
- Motnje spanja
- Zdravljenje z depresijo
- Zdravljenje manije
- Zmanjšanje apetita
Motnje pomanjkanja
Osrednjo izločanje ali pomanjkanje triptofana spremljajo depresija, neuspehi v pozornosti, zmanjšanje spomina, spanja in anksioznih motenj.
Pri depresivnih bolnikih in s samomorilnimi trendi so našli spremembe koncentracije krvi in cerebrospinalne tekočine. Poleg tega nekateri bolniki z živčno anoreksijo kažejo nizko serumsko raven triptofana.
Nekateri polivrični bolniki, ki izgubijo vitamin B6 in cink.
Za karcinoidni sindrom je značilna prisotnost tankih črevesnih tumorjev, ki povzročajo drisko, vaskularne bolezni in bronhokonstrikcijo in je povezana z niacinskim in tritofanskim primanjkljajem
Pelagra je patološko stanje, ki ga spremljajo driska, demenca, dermatitis in lahko povzroči smrt, to se zdravi tudi z dodatki niacina in triptofana.
Hartnup -ova bolezen mora med nekaterimi stvarmi storiti z napako v presnovi več aminokislin, vključno s triptofanom.
V primeru primanjkljaja encima encima tiptofana -2,3-monoksigenaze je to recesivna dedna bolezen, za katero so značilne duševne zaostalost in spremembe kože kože.
Reference
- Halvorsen, K., & Halvorsen, s. (1963). HARTNUP bolezen. Pediatrija, 31(1), 29–38.
- Kapuca, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Don paniko. Vodnik za izčrpavanje triptofana z motnjo specifično provokacijo tesnobe. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, t. Do., Nguyen, j. C., Polglaze, k. In., & Bertrand, str. Str. (2016). Vpliv triptofana in serotonina na razpoloženje in spoznanje z možno vlogo osi črevesja. Hranila, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. Do., Fernstrom, J., Fernstrom, m.,… & Kishore, a. (2003). Anksiolitični učinki akutnega izčrpavanja triptofana pri anoreksiji nervozi. International Journal of Eating Motnje, 33(3), 257-267.
- Murray, r. K., Granner, d. K., Mayes, str., & Rodwell, v. (2009). Harperjeva ilustrirana biokemija. 28 (P. 588). New York: McGraw-Hill.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehningerjeva načela biokemije. Macmillan.

