Elektronska afiniteta
- 3233
- 127
- Percy Feeney
Kaj je elektronska afiniteta?
The Elektronska afiniteta Opredeljen je kot količina energije, ki se sprosti, ko se mol atomov v plinastem stanju združi z molom elektronov, da tvori mol anionov, tudi v plinastim stanju. Z drugimi besedami, nanaša se na negativno različico entalpije naslednjega postopka:
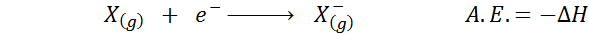
Kot že ime pove, elektronska afiniteta (a.In.) To je merilo trenda, ki ima atom, da se pridruži elektronu. To pomeni, da meri afiniteto atoma za elektrone.
Interpretacija elektronske afinitete
Zaradi načina opredelitve visoka elektronska afiniteta pomeni, da je nihanje entalpije zelo negativno. To posledično kaže, da je postopek energijsko ugoden in da so izdelki bolj stabilni od reagentov. Zaradi tega bi lahko rekli tudi, da je elektronska afiniteta posredno merilo stabilnosti aniona.
Večja kot je elektronska afiniteta atoma, večji je trend, da tvori anion. Zato atomi, kot je klor, katerih elektronska afiniteta je 349 kJ/mol, ponavadi zlahka tvorijo anione (v tem primeru klorid anion), medtem ko drugi atomi, kot je magnezij, katerih elektronska afiniteta je negativna, ne tvorijo anionov.
Pojasnitev elektronske afinitete in ionizacijske energije
Velikokrat razmišljate o elektronski afiniteti kot nasprotju z ionizacijsko energijo (težnja plinastega atoma, da izgubi elektron), vendar to ni tako. Razmislite na primer atom x.
Lahko vam služi: Tusfrano: Kemična struktura, lastnosti in uporabeNjegova elektronska afiniteta se nanaša na spremembo energije zgoraj prikazanega v prvi enačbi. Vendar se njegova ionizacijska energija nanaša na spremembo energije, ko atom izgubi elektron:
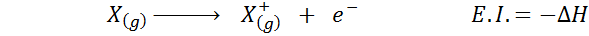
Čeprav se zdi, da je ta reakcija nasprotna reakcija na prejšnjo.
Kaj določa elektronsko afiniteto?
Če želite vedeti, katere značilnosti atoma vplivajo na vrednost njene elektronske afinitete, je treba upoštevati stabilnost prvotnega atoma, pa tudi anion, ki se tvori. Če je anion bolj stabilen od atoma, bo elektronska afiniteta visoka, sicer bo nizka ali celo negativna.
Toda kako vedeti, katera od obeh vrst je bolj stabilna? Za to se zanašamo na dva dejavnika:
- Elektronska konfiguracija. Obstajajo bolj stabilne elektronske nastavitve kot druge. Na splošno je konfiguracija celotne plasti (na primer plemeniti plini) najbolj stabilna od vseh. Nato ji sledi konfiguracija pol-LLLena plasti, v kateri imajo vse orbitale plasti Valencije polovico elektronov, ki bi jih lahko imeli (na primer 4s14p3).
- Elektronsko odbojnost. Če se primerjava Anion -1 primerja z anionom obremenitve -2, bo v drugem primeru veliko več odbojnosti med elektroni, ki destabilizira anion.
Periodična tendenca elektronske afinitete
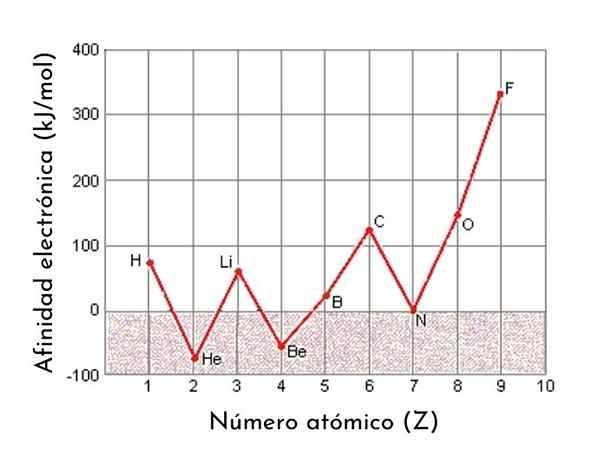
 Graf, ki prikazuje elektronske afinitete prvih 9 elementov periodične tabele
Graf, ki prikazuje elektronske afinitete prvih 9 elementov periodične tabele Elektronska afiniteta je ena od periodičnih lastnosti elementov. To pomeni, da je lastnost, ki se predvidljivo razlikuje od enega elementa do drugega, odvisno od njegovega položaja v periodični tabeli. Na splošno se elektronska afiniteta poveča, ko se velikost atoma zmanjšuje.
Lahko vam služi: pol -razvita formula: kaj je in primeri (metan, propan, butan ...)V tem smislu se velikost atomov razlikuje glede na obdobje in skupino, v kateri se nahaja, zato se tudi njegova elektronska afiniteta spreminja, kot je razloženo spodaj:
Sprememba elektronske afinitete v obdobju
Vsaj za reprezentativne elemente (ki pripadajo blokom S in P periodične tabele), lahko opazimo, da ima elektronska afiniteta splošno nagnjenost k povečanju od leve proti desni je sposoben pritegniti elektrone z večjo silo.
Na primer, če vzamemo 3. obdobje periodične tabele, lahko vidimo, da je elektronska afiniteta Li (60 kJ/mol) manjša od kisika (141 kJ/mol) in to je manj kot pri fluoridu (328 kJ /mol).
Izjeme
Prejšnje pravilo ni vedno izpolnjeno.
Prvič, pri prehodu iz alkalnih kovin v alkalinerje se elektronska afiniteta zmanjša. To je zato, ker za alkalne kovine (NS Elektronska konfiguracija1) Ugodno je zajeti elektron, saj bi končali z zapolnitvijo svojega orbitala.
V primeru alkalineros (elektronska konfiguracija NS2) Zajem elektrona je neugoden, ker že imajo svojo polno orbitalo. Enako se zgodi pri premikanju iz halogenov (ki imajo elektronske afinitete vseh elementov) na plemenite pline.
Sprememba elektronske afinitete v celotni skupini
V primeru skupin je vedenje še manj predvidljivo. Splošno pravilo je, da a.In. povečuje od spodaj navzgor, v isti smeri, ki zmanjšuje atomski polmer. Za alkalne in halogenske kovine je to pravilo precej dobro izpolnjeno. Vendar se to ne zgodi pri večini drugih skupin.
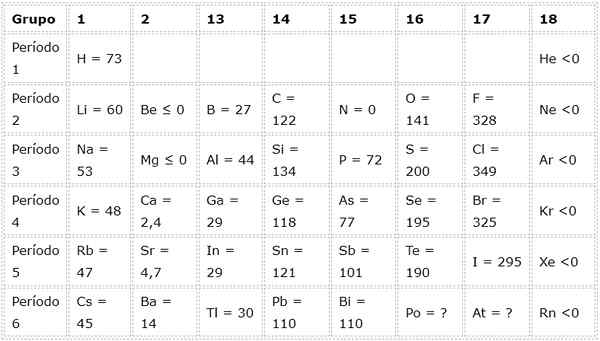
Vam lahko služi: kobalt hidroksidPrimeri elektronske afinitete nekaterih reprezentativnih elementov
Naslednja tabela prikazuje vrednosti elektronske afinitete v (kj/mol) Reprezentativni elementi Razvrščena po skupinah:
Spodaj je nekaj primerov elektronske afinitete skupaj z reakcijo, na katero se nanašajo:
1. Vodikova elektronska afiniteta
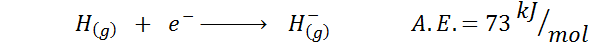
2. Elektronska afiniteta kisika
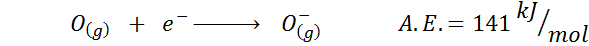
3. Anionska elektronska afiniteta
Drug pogost primer je primer elektronske afinitete aniona, kot je oz-. A.In. V tem primeru jo daje energija, povezana z naslednjim postopkom:
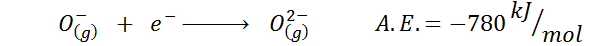
Kot je razvidno, je ta elektronska afiniteta močno negativna, čeprav ion ali2- Ima elektronsko neonsko konfiguracijo (plemenit plin) in biti zelo pogost ion v mnogih ionskih trdnih snovi.
Razlog je v tem, da odboj negativnih nabojev v oz2- destabilizira ta plinasti državni ion, toda v trdnem stanju obremenitev stabilizirajo kationi.

