Piridinska struktura, lastnosti, uporabe, toksičnost, sinteza
- 2425
- 672
- Stuart Armstrong
The Piridin Je aromatičen amin, katerega kemijska formula je c5H5N. To je dušikova različica benzena, saj je skupina -ch = nadomestila dušikov atom (n). Skupaj s pirolom piridin tvori skupino preprostejših aromatičnih aminov vseh.
Sprva se je piridin pojavil iz Hulla Tar, vendar je bil malo metode zmogljivosti. To je privedlo do ustvarjanja več metod za njegovo kemično sintezo, ki je prevladovala tiste, v kateri se uporablja reakcija formaldehida, acetaldehida in amoniaka.
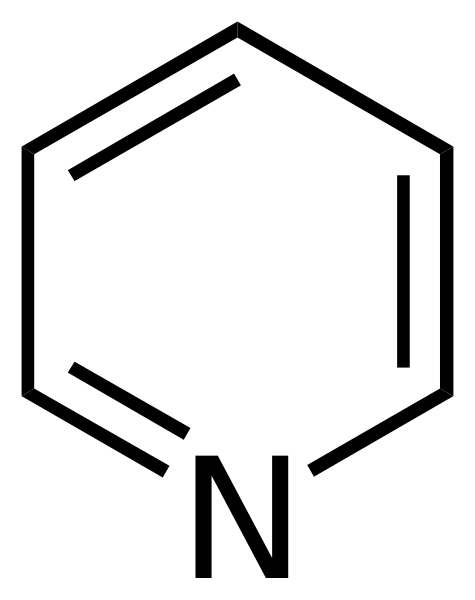 Strukturna formula piridina. Vir: Calvero. / Javna domena
Strukturna formula piridina. Vir: Calvero. / Javna domena Piridin je prvič dobil Thomas Anderson (1843), kemik, ki je skozi ogrevanje živalskega mesa in kosti proizvedel olje, iz katerega je bil piridin očiščen.
 Thomas Anderson (julij 1819)
Thomas Anderson (julij 1819) Piridin se uporablja kot surovina za sintezo spojin, ki odpravljajo in nadzirajo širjenje žuželk, gliv, zelišč itd. Uporablja se tudi pri izdelavi številnih zdravil in vitaminov, poleg tega pa se uporablja kot topilo.
Piridin je strupena spojina, ki lahko kronično poškoduje jetra, ledvice in delovanje centralnega živčnega sistema. Piridin lahko vstopi v telo zaradi zaužitja, vdihavanja in razširjanja skozi kožo. Znano je v kemikaliji, ker je snov, ki lahko povzroči nemoč pri moških.
[TOC]
Piridinska struktura
Molekularna
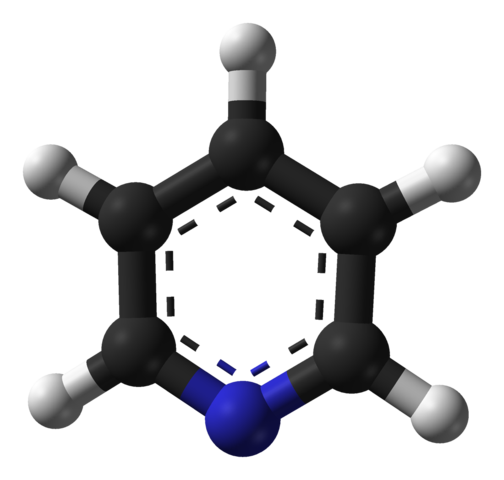 Molekularna struktura piridina. Vir: Benjah-BMM27 / javna domena
Molekularna struktura piridina. Vir: Benjah-BMM27 / javna domena Vrhunska slika prikazuje molekularno strukturo piridina, ki jo predstavlja model sfer in palic. Kot je razvidno, je njegova molekula zelo podobna moči benzena, edina razlika, da ima eno od svojih ogljikov (črne kroglice), ki jo nadomesti dušik (modra krogla).
Dušik, ker je bolj elektronegativen, privlači elektronsko gostoto do sebe, kar ustvarja trajni dipolski trenutek v piridinu. Zato molekule piridina delujejo skozi dipole-dipolo sile.
Vodikovi atomi so najrevnejša območja v elektronih, tako da bodo usmerjeni v smeri dušikovega atoma sosednje molekule.
Kristalna
 Kristalna struktura piridina. Vir: ORCI/CC by-S (https: // createCommons.Org/licence/by-sa/3.0
Kristalna struktura piridina. Vir: ORCI/CC by-S (https: // createCommons.Org/licence/by-sa/3.0 Piridinske molekule nimajo samo dipol-dipolo sil, ampak tudi z interakcijami aromatičnih obročev. Tako se te molekule uspejo postaviti tako, da pri temperaturi -41,6 ° C povzročijo kristal OrTorrambic Structure (zgornja slika).
Lastnosti piridina
 Vzorec piridina. Lhchem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0
Vzorec piridina. Lhchem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0 Fizični videz
Brezbarvna tekočina, s prodornim vonjem, podobno kot ribe.
Lahko vam služi: metoda redox ravnovesja: koraki, primeri, vajeMolarna masa
79,1 g/mol
Gostota
0,9819 g/ml
Tališče
-41,6 ° C
Vrelišče
115,2 ° C
Topnost
Menjava je z vodo in tudi z alkoholom, etrom, naftnim etrom, olji in številnimi organskimi tekočinami na splošno.
Parni tlak
16 mmHg pri 20 ° C.
Gostota hlapov
2,72 glede na vodo = 1
Indeks loma (nD)
1.5093
Goo
0,88 CP
Dipolarni trenutek
2.2 d
točka vžiga
21 ° C
Temperatura samousmernosti
482 ° C
Razgradnja
Ko se segreje na razgradnjo, oddaja cianidni dim.
Korozija
Piridin v tekoči obliki napade nekatere oblike plastike, gume in premazov.
ph
8,5 (0,2 m raztopina v vodi)
Basic in reaktivnost
Piridin je šibka podlaga. Gre za terciarni amin, katerega raztopina 0,2 M v vodi proizvaja pH 8,5. Ima malo afinitete do elektronov zaradi dušikove elektronegativnosti, zato njihovi ogljikovi običajno ne trpijo elektrofilne substitucije.
Piridin doživi nukleofilno substitucijo, po možnosti na položajih c4 in c2 Iz prstana. Zaradi svoje sposobnosti darovanja elektronov je piridin bolj oksidacija več kot benzen in silovito reagira z žveplovo kislino, dušikovo kislino in anhidridom maleico.
Uporaba piridina
Pesticidi
Piridin je predhodnika herbicida in diquat. Na enak način služi za sintezo insekticida klorpirifosa, katerega začetni korak je kloriranje piridina. To je tudi začetna surovina za pridobitev fungicida na podlagi piricije.
Topilo
Piridin je polarno topilo, ki se uporablja za reakcije prodajalcev in ekstrakcijo antibiotikov. Piridin se uporablja kot topilo v industriji barv in gume, pa tudi v raziskovalnih laboratorijih kot topilo pri ekstrakciji rastlinskih hormonov.
Zdravilo
Piridin služi kot začetna točka v sintezi cetilpiridinija in laurilpiridinija, spojin, ki se uporabljajo kot antiseptiki v produktih oralne in zobozdravstvene oskrbe. Molekula piridina je del kemijske strukture številnih zdravil.
Na primer, esmeprazol, ki se uporablja pri zdravljenju gastroezofagealnega refluksa. Loratidin je še eno zdravilo, pripravljeno na podlagi piridina, znanega kot Claritin, ki se uporablja kot zdravljenje alergijskih procesov.
Tablete piridina (fenazopiridin) se uporabljajo pri simptomatskem zdravljenju draženja sečil, ki ga v nekaterih primerih spremljajo bolečine, gorenje in nujnost uriniranja. Fenazopiridin je barvilo, ki izpolnjuje analgetično funkcijo v sečil.
Di-acilhidrazin je piridinski derivat, ki ima antibakterijsko aktivnost, ki ima gram negativne bakterije, na primer In. coli, in gram pozitivne bakterije, kot so S. Albus.
Piridin služi kot osnova za tiazolo [5,4-6] piridin, sestavljen iz protivirusne aktivnosti, zlasti proti virusu β-mase gripe. 2-acetilpiridin, piridinski derivat, ima veliko protitumorsko aktivnost in je zaviralec levkemije.
Vam lahko služi: živosrebrni oksid (HG2O)Drugi
Piridin se uporablja pri proizvodnji vitaminov, gumijastih izdelkov, lepil, slik in insekticidov. Uporablja se tudi pri denaturaciji alkohola in pri obarvanju nekaterih tekstila.
20 % piridina se uporablja pri pripravi piperidina. Piperidin posega v vulkanizacijo in kmetijstvo.
Piridin se uporablja tudi pri sintezi polikarziranih smol, kot okus hrane in kot reagent za odkrivanje cianida.
Strupenost
- Piridin vstopi v organizem predvsem zaradi vdihavanja in difuzije skozi kožo. Akutna izpostavljenost piridinu lahko povzroči draženje in opekline v očeh in koži.
- Piridin lahko izvira dermatitis in alergijo na koži. Razvoj alergije lahko spremljamo poleg srbenja in izpuščaja.
- Vdihavanje piridina lahko povzroči draženje nosu in grla, ki ga spremlja kašelj in astmatični dihalni dih.
- Z zaužitjem lahko piridin povzroči slabost, bruhanje, drisko in bolečine v trebuhu. Prav tako lahko vgradnja visokega odmerka piridina v organizem povzroči: glavobol, utrujenost, bledenje, osupljivo, omotico, zmedo in sčasoma prehranjevanje in smrt.
- Organi, ki jih najbolj prizadene delovanje piridina, so jetra, ledvice, moške genitalije in centralni živčni sistem. Lahko deluje tudi na kostnem mozgu, kar povzroči proizvodnjo krvnih trombocitov. Kancerogeno delovanje piridina pri živalih ni bilo dokazano.
OSHA je vzpostavila izpostavljenost v zraku 5 ppm na 8 -urni delovni dan.
Sinteza
Prve metode pridobivanja piridina so temeljile na njegovi ekstrakciji organskih materialov. Thomas Anderson (1843) je prvič dobil piridin s segrevanjem mesa in živalskih kosti. V prvi fazi je Anderson izdelal olje, iz katerega mu je uspelo destilirati piridin.
Tradicionalno je bil piridin pridobljen iz uplinjanja Hulla Tar ali premoga. Ti postopki so bili okorni in malo zmogljivosti, saj je bila koncentracija piridina v teh surovinah zelo nizka. Metoda sinteze je bila potrebna.
Chichibabin metoda
Čeprav obstaja veliko metod za sintezo piridina, se postopek Chichibabina, uvedenega leta 1923, še vedno uporablja predvsem. Pri tej metodi se piridin sintetizira iz reakcije formaldehida, acetaldehida in amonijaka, ki so poceni reagenti.
Vam lahko služi: vrsta povezave 02V prvi fazi se formaldehid in acetaldehid reagirata tako.
 Piridinska kondenzacija iz Acroleína in Acetaldehida
Piridinska kondenzacija iz Acroleína in Acetaldehida Končno v drugi fazi Acroleína reagira s formaldehidom in amonijakom, da tvori dihidropiridin. Nato se dihidropiridin oksidira v piridin v reakciji pri 350 -550 ° C v prisotnosti trdnega katalizatorja, na primer kremena -alumina.
Reakcije
Elektrofilne substitucije
Te nadomestitve se običajno ne pojavijo zaradi nizke elektronske gostote piridina.
Sulfanacija predstavlja večjo težavo kot nitracija. Toda bromacija in kloriranje se lažje pojavita.
Piridin-N-oksid
Mesto oksidacije v piridinu je atom dušika, ki je oksidacija, ki jo proizvajajo breskve (kisline, ki imajo skupino OOH). Oksidacija dušika spodbuja elektrofilno substitucijo v ogljikih 2 in 4 piridina.
Nukleofilne substitucije
Piridin lahko doživi več nukleofilnih substitucij zaradi nizke elektronske gostote ogljika piridin. Te substitucije se lažje pojavljajo v molekuli piridina, spremenjene z bromom, klorom, fluorom ali sulfonsko kislino.
Spojine, ki jih izvajajo nukleofilni napadi na piridin, so običajno: alcoksidi, tyolati, amini in amonijak.
Radikalne reakcije
Piridin lahko utripamo z radikalnimi reakcijami. Radikalna piridinska dimerizacija se izvaja z osnovnim natrijem ali nikljevim ranejem, ki lahko proizvaja 4,4'-bipperin ali 2,2'-bipperidin.
Reakcija na dušikovo atom
Kisline po Lewisu zlahka dodajo dušikovi atom piridina, ki tvorijo piridinske soli. Piridin je baza Lewis, ki podari nekaj elektronov.
Hidrogenacija in reakcija redukcije
Piperidin nastane s hidrogeniranjem piridina z nikljem, kobaltom ali rutenijem. Ta reakcija je narejena pri visokih temperaturah, ki jih spremlja uporaba katalizatorja.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Wikipedija. (2020). Piridin. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Piridin. Baza podatkov Pubchem., Cid = 1049. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Laura Foist. (2020). Piridin: struktura, formula in fizikalne lastnosti. Študij. Okrevano od: študij.com
- Atof Ali Altaf, Adnan Shahzad, Zarif Gul, Nasir Rasool, Amin Badshah, Bhajan Lal, Ezzat Khan. (2015). Pregled o zdravilnem pomenu piridinskih derivatov. Časopis za oblikovanje zdravil in zdravilne kemije. Vol. 1, ne. 1, str. 1-11. Doi: 10.11648/j.Jddmc.20150101.enajst
- Webmd. (2020). Piridinska tableta. Pridobljeno iz: webmd.com
- Ministrstvo za zdravje in starejše storitve New Jerseyja. (2002). Piridin. [PDF]. Okreval od: NJ.Gov
- « C ++ Zgodovina, značilnosti, vrste podatkov, primeri
- Essential maščobne kisline, pomembnost, nomenklatura, primeri »

