Enakovredna teža
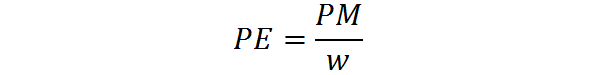
- 3470
- 795
- Lee Farrell
Kakšna je enakovredna teža?
On enakovredna teža Je teža ali masa ekvivalenta snovi. To pomeni, da je teža ali masa snovi, ki je kemično enaka 1 mol druge snovi iste vrste, ki se uporablja kot referenčni vzorec in velja za normalno.
Običajna snov, ki je bila vzeta kot referenca, je odvisna od vrste vpletene kemijske reakcije in vloge, ki jo ima spojina v tej reakciji. Običajne spojine se med seboj vedno reagirajo s stehiometrijo 1: 1.
Na primer, če govorimo o kislini/bazni reakciji, bi bila enakovredna teža kisline teža omenjenega spojine, enakovredna 1 molu normalne kisline, ki ima en sam ionizabilen proton.
Preden je bilo znano, da so bile materije oblikovane z atomi in molekulami, je bila že določena vrsta zakonov, ki so določili množično razmerje (ali teža) med reagenti in produkti kemijske reakcije.
Ti zakoni so oblikovali osnove stehiometričnih izračunov med začetki kemije kot znanosti.
Koncept enakovredne teže je povezan s to zgodnjo fazo razvoja kemije. Nato bomo razpravljali o tem, kako se izračuna, za kaj gre in nekaj skupnih primerov vašega izračuna.
Formula in enakovredne teže
Enakovredna teža se izračuna iz molekulske mase ene snovi z naslednjo formulo:
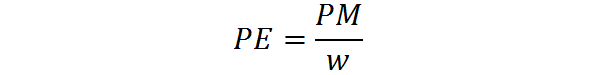
Kadar je PE enakovredna teža, je PM molekulska teža ali molarna masa snovi in W predstavlja število ustreznikov na mol.
Slednje je vedno sestavljeno iz celotnega ali večjega od 1. Predstavlja število molekul "normalnega" reagenta, na katerega je vsaka molekula snovi enakovredna. Zato je odvisno od vrste zadevnega reagenta in vrste kemijske reakcije.
Vam lahko služi: dihidroxyaceton: struktura, lastnosti, pridobivanje, uporabeIzračuna se lahko tudi iz testa, m in števila enakovrednih:
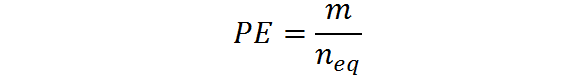
Enakovredne teže
Kot je razvidno iz prejšnje formule, je enakovredna teža izražena v masnih enotah (običajno grami) na številu enakovrednih. To pomeni, da so enote g/eq.
Vrednost W V prvi prejšnji formuli je izražen v enakovrednih enotah na mol (EQ/mol), medtem ko je molarna masa izražena v gramih nad mol (g/mol).
Za kaj je enakovredna teža?
Glavna uporabnost enakovredne teže je, da poenostavlja stehiometrične izračune. Enakovredna teža snovi je enakovredna drugi snovi iste vrste in za isto vrsto kemijske reakcije. Pravzaprav od tam pridobi ime.
To nam omogoča, da na zelo preprost način izvajamo stehiometrične izračune in brez potrebe po pisanju in uravnoteženju kemičnih enačb.
Kako se izračuna enakovredna teža?
Kot smo videli že prej, se enakovredna teža izračuna iz molekulske mase in števila ekvivalentov na mol ali W.
Izračun molekulske mase
Molekulska masa snovi se določi z dodajanjem atomske mase vseh atomov, ki jo sestavljajo. Te atomske teže najdemo v periodični tabeli.
Določitev W
Vrednost W Za snov je odvisno od vrste reakcije, v kateri je vključena. To pomeni, da je odvisno od vrste zadevnega reagenta. Za vsako vrsto snovi obstaja drugačen način določanja W.
Naslednja tabela prikazuje, kako je določena W Za različne primere.
Lahko vam služi: kalcijev hipoklorit (CA (CLO) 2)| Vrsta reagenta | Vrednost W |
| Kisline | Število ionizabilnih vodikov za vsako kislinsko molekulo. |
| Baze | Število protonov, ki lahko zajamejo ali nevtralizirajo vsako osnovno molekulo. |
| Oksidacijska sredstva | Število elektronov, ki zajamejo vsak mol oksidacijskega sredstva pri pol -priklopu zmanjšanja. |
| Zmanjševanje sredstev | Število elektronov je sprostilo vsak mol reducirajočega sredstva v oksidacijski poltrakciji. |
| Greš ven | Skupno število pozitivnih ali negativnih nabojev, ki se ustvarijo, ko ena soli. |
| Nevtralne snovi | 1 |
Treba je opozoriti, da lahko, če lahko snov sodeluje v več vrstah kemijske reakcije W In zato več kot ena enakovredna teža.
Pomen in uporabe enakovredne teže
Enakovredna teža se uporablja za izračun števila ekvivalentov kemikalije. To število ekvivalentov je vedno enako številu ekvivalentov druge snovi, s katero reagira.
To se uporablja predvsem na dveh različnih področjih:
V analitični kemiji
Ekvivalenti se pogosto uporabljajo za olajšanje stehiometričnih izračunov v analitični kemiji. To še posebej velja v primeru volumetrične in gravimetrične analize.
Poznavanje volumna stopnje na mestu enakovrednosti in koncentraciji titularne, pa tudi enakovredne teže upravičenega, zlahka omogočajo izračun mase analita, ki je prisotna v vzorcu.
V elektrolizi
Na področju elektrolize enakovredna teža predstavlja težo ene kovine ali druge snovi, ki se lahko pojavi, ko 96.500 C Nalaganje skozi elektrolitsko celico. To olajša stehiometrične in ekonomske izračune procesa elektrolize.
Vam lahko služi: živosrebrni oksid (HG2O)Primeri enakovrednega izračuna teže
Kalcij
Atomska teža kalcija je 40 in ta kovina tvori katione z Valencijo +2, tako da je njegova enakovredna teža 40/2 = 20 g/eq.
Žveplova kislina (h2SW4)
Molekulska teža te spojine je 98 in je diprotična kislina, torej W = 2. Zato je enakovredna teža PE: 98/2 = 49 g/eq.
Aluminijev hidroksid (AL (OH)3)
Aluminijev hidroksid (PM = 78) je amfoterska spojina, ki lahko deluje kot kislina in kot osnova.
Če delujete kot baza, tako da sprostite svoje tri hidrokside, potem W = 3, Torej PE: 78/3 = 26 g/eq. Po drugi strani pa, ko deluje kot kislina, zajame molekulo vode in sprosti proton, torej v tem primeru, W = 1 in pe = 78 g/eq.
Kalcijev fosfat (ca3(Po4)2)
Kalcijev fosfat je sol, ki pri ločevanju proizvaja 3 ione2+ in 2 ions Po43-.
Vsekakor je število obremenitev istega znaka, ki ga ustvari vsaka kalcijeva fosfatna enota W = 6 in pe = 310/6 = 51,67 g/eq.
Reference
- Univerzalna enciklopedija. F.). Enakovredna teža. Vzeti iz Encyclopedia_universal.Es-akademska.com.
- Kemija, anorganska kemija. F.). Enakovredna teža. Vzeti iz fullquimice.com.
- Kemija.Je (s. F.). Enakovreden. Vzeti iz kemije.je.
- SPIEGATO (2021). Kakšna je enakovredna teža? Vzeti iz Spiegato.com.

