Toplota izhlapevanja

- 765
- 42
- Miguel Gutmann DVM
 Toplota izhlapevanja ali uparjanja je tista, ki trpi kemikalijo za spremembo tekočega stanja v plinasto
Toplota izhlapevanja ali uparjanja je tista, ki trpi kemikalijo za spremembo tekočega stanja v plinasto Kaj je toplota izhlapevanja?
On Toplota izhlapevanja, Imenujejo se tudi toplota uparjanja, opredeljena je kot količina toplote, ki jo čista kemija absorbira, da izhlapi, to je, da trpi spremembo stanja iz tekočega stanja v stanje plina.
To pomeni, da gre za toploto, povezano z naslednjim postopkom spremembe faze:
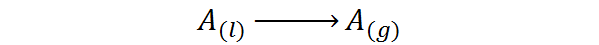
Gre za vrsto toplote, ki ne povzroča zvišanja temperature, ampak razbije sile, ki ohranjajo molekule tekočine skupaj. Na ta način je mogoče molekule ločiti drug od drugega in jih osvoboditi do plinske faze.
Formula in enote
Toplota izhlapevanja ali izhlapevanja je mogoče predstaviti s simbolom QVap. To je obsežen znesek, to je odvisno od količine snovi.
V tem smislu ga lahko izračunamo iz količine snovi in intenzivne mere toplote izhlapevanja.
Ko je količina snovi izražena v obliki mase, je treba uporabiti latentno toploto izhlapevanja ali uparjanja, lVap, V tem primeru je toplota izhlapevanja izražena kot:
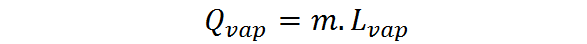
Latentna toplota uparjanja je intenzivna in značilna količina vsake snovi. To je bolj ali manj neposredno merilo, kako močne so medmolekularne interakcije med delci, ki sestavljajo tekočino.
Po drugi strani je mogoče izračunati tudi toploto izhlapevanja iz števila molov, v tem primeru pa je potrebna molarna toplota uparjanja, imenovana tudi entalpija izhlapevanja:
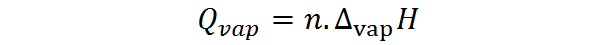
Kje n predstavlja število molov in ∆VapH je entalpija izhlapevanja snovi. Entalpija uparjanja predstavlja količino konstantnega tlaka, ki je potreben za izhlapevanje mola snovi.
Lahko vam služi: propanska kislinaToplotne enote izhlapevanja
Ker je vrsta toplote, ki je oblika energije, se toplota izhlapevanja izraža v energetskih enotah. Najpogosteje uporabljene enote so:
- Kalorije (apno)
- Kilokarne (kcal ali apno)
- Jouls ali Joules (J)
- Kilojouls ali Kilojulios (KJ) itd.
Po drugi strani pa latentna toplota izhlapevanja (lVap) Izražena je v enotah za množično energijo. Na primer:
- apno/g
- Kcal/g
- Kcal/kg
- kJ/g
- KJ/kg itd.
Končno, entalpijo uparjanja (∆VapH) Izražena je v energetskih enotah na enotah količine snovi, običajno molov. Nekaj primerov je:
- apno/mol
- Kcal/mol
- J/mol
- KJ/mol itd.
Kako se izračuna toplota izhlapevanja?
Kot smo videli pred trenutkom, lahko toploto izhlapevanja izračunamo iz mase ali števila molov in latentne toplote izhlapevanja ali entalpije izhlapevanja.
Vendar se te količine običajno določijo eksperimentalno, kar meri količino toplote, potrebne za izhlapevanje določene mase snovi in nato čiščenje ene od dveh prejšnjih enačb.
Zaradi zgoraj navedenega je skupna stvar, da se toplota izhlapevanja izračuna, ampak da se v laboratoriju meri eksperimentalno.
Po drugi strani pa je entalpija kot termodinamična lastnost sistema stavna funkcija, to je mogoče izračunati iz drugih entalpij, ki se nanašajo na snov v tekočem stanju z isto snovjo v plinasto stanje.
Na primer, entalpijo uparjanja lahko izračunamo tako, da odštejemo sublimacijsko entalpijo, razen fuzijske entalpije snovi. Nato se za določitev toplote izhlapevanja vzorca uporabljata ta entalpija in število molov.
Vam lahko služi: aluminijev poliklorid: struktura, lastnosti, pridobivanje, uporabeAplikacije za izhlapevanje
Obstaja veliko polj, na katerih se uporablja toplota izhlapevanja. Pravzaprav bo v vsakem postopku, ki vključuje kemikalijo, ki je naenkrat v tekočem stanju in v drugem v plinastem stanju.
Toplota izhlapevanja je vedno pozitivna, saj je vedno treba absorbirati toploto, da prekinemo združitev med molekulami, ki tvorijo tekočino. Snov absorbira to toploto iz neposredne okolice, zato izgubijo toploto, ko tekočina izhlapi.
Uravnavanje toplote in telesne temperature izhlapevanja
To je načelo delovanja znojenja kot sistema za regulacijo telesne temperature.
Ko se znojimo, voda znoja izhlapi na površini naše kože. Ker je koža v neposrednem stiku z znojem, tam voda pridobi toploto izhlapevanja.
Potem, ko izhlapi, znojna voda nosi s seboj količino toplote kože, ki se ohladi, prav tako hladi kri, ki teče skozi kapilare kože in navsezadnje notranjost telesa.
Toplota izhlapevanja v industriji
Energija je eden največjih stroškov za številne panoge in mnogi od njih morajo porabiti energijo za izhlapevanje različnih snovi. Zaradi tega je za izračun obratovalnih stroškov potrebno izračunati količino toplote, potrebne za izhlapevanje različnih tekočin.
Na primer, če farmacevtsko podjetje sintetizira zdravilo v alkoholni raztopini, bo verjetno moralo izhlapevati in posušiti izdelek, da odpravi vse alkohol. Toplota izhlapevanja nam omogoča, da ugotovimo, koliko energije bo potrebno za to.
Lahko vam služi: periódinska kislina (HIO4): kaj je, struktura, lastnosti, uporabeProizvodnja ledu na vlaku
Pred obstojem električne energije so vlaki z izhlapevalnim toploto zamrznili vodo in tako med potovanjem naredili led. Postopek je podoben znojenju in deluje na enak način.
Na postaji vlak priklene usnjeno vrečko, ki vsebuje tekočo vodo. Torba ni popolnoma hermetična, zato je zunanjost navlažena. Med potovanjem zrak hitro izhlapi vodo s površine vrečke, absorbira toploto tekoče vode in jo ohladi, da jo zamrzne.
Primeri izhlapevanja segrejejo
Naslednja tabela vsebuje latentne toplote uparjanja ali izhlapevanja za nekatere običajne kemikalije.
| Snov | Latentna toplota uparjanja (LVap/kJ.g-1) | Entalpija izhlapevanja (∆VapH/kJ.mol-1) |
| Voda (h2Da) | 2.260 | 40.657 |
| Etanol (pogl3Pogl2OH) | 0,837 | 38.56 |
| Vodikov sulfid (h2S) | 0,6422 | 21.90 |
Reference
- Ehu.Je (s. F.). Latentna toplota vodne uparjanja. Vzeti iz SC.Ehu.je.
- Luz, g. (s. F.). Toplota za uparjanje. Vzeti iz materialov.Gelsonluz.com.
- Soler & Palau (2019). Latentna toplota: fuzija in uparjanja. Vzeti iz Solerpalaua.com.
- SPIEGATO (2021). Kakšna je toplota uparjanja? Vzeti iz Spiegato.com.

