Elektrolitične celice
- 3217
- 521
- Don Nitzsche
 Elektrolitične celice so elektrokemična naprava za povečanje reakcij ne -spontanih oksida z elektriko
Elektrolitične celice so elektrokemična naprava za povečanje reakcij ne -spontanih oksida z elektriko Kaj so elektrolitske celice?
The Elektrolitične celice So naprave, ki se uporabljajo za povečanje kemičnih reakcij ne -spontanega zmanjšanja z uporabo električne energije. Z drugimi besedami, gre za celice, v katerih se izvaja postopek elektrolize, in zato njegovo ime.
Je posebna vrsta elektrokemičnih celic. To pomeni, da gre za naprave, v katerih vrsta, ki oksidira in tiste, ki se zmanjšajo.
Zaradi tega se izmenjava elektronov med oksidacijskimi in reduktorskimi vrstami ne pojavi neposredno, ampak prek zunanjega prevodnika.
V primeru, da se redoks reakcija pojavi spontano, torej brez pomoči zunanjega vira energije govorimo o galvanskih celicah.
Primer je avtomobilska baterija. Po drugi strani pa, če reakcija zahteva zunanji vir energije, gre za elektrolitsko celico.
Delovanje elektrolitskih celic
Vsako elektrolitsko celico tvori nekaj osnovnih elementov, ki so:
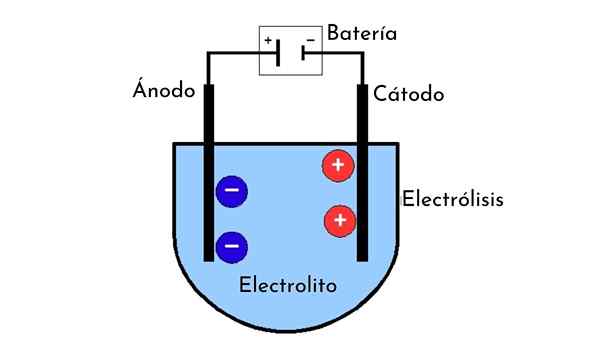
- Dve elektrodi, imenovani anoda in katoda.
- Raztopina snovi, ki jo nameravamo podrediti elektrolizi ali, če tega ni, ta ista snov v tekočem stanju (na primer staljena sol).
- Električni vodniki.
- Električni vir energije.
Postopek se izvede za reakcije, ki v normalnih pogojih niso spontane. To pomeni, da gre za zmanjšanje reakcij rje, katerih celični potencial glede na koncentracije vrste in temperaturne in tlačne pogoje je negativno.
To pomeni, da elektroni nimajo nagnjenosti k prehodu od vrst, ki jih želimo oksidirati, do katere želimo zmanjšati, temveč v nasprotno smer. Z uporabo zunanje napetosti nasprotnega znaka lahko vložimo znak celičnega potenciala, s čimer prisilimo reakcijo.
Vam lahko služi: topni materialiKot vsaka redoks reakcija, se tudi elektroliza pojavlja v obliki dveh pol -reakcij, ki se v obeh elektrodah pojavijo ločeno. Temu se imenujejo katoda in anoda.
Katoda
Katoda je elektroda, povezana z negativnim polom vira energije, in tam se pojavi pol -reakcija redukcije. To je tudi elektroda, kamor so med elektrolizo usmerjeni pozitivni ioni. Pravzaprav od tod prihaja ime kationov.
Ko predstavljamo postopek elektrolize v obliki celičnega diagrama, je polčas redukcije, ki se pojavi v katodi, vedno nameščen na desni strani.
Anoda
Anoda je elektroda, ki nasprotuje katodi. To pomeni, da je elektroda, povezana s pozitivno močjo vira energije, in v kateri se pojavi oksidacijska pol -svetloba. To je tudi kraj, na katerega so usmerjeni ioni z negativno obremenitvijo (anioni) in so vedno predstavljeni na levi strani celičnega diagrama.
Pretok elektronov v elektrolitski celici
Ko so elektrode priključene na nasprotne drogove vira energije, ki ima dovolj potencial, se vezje zapre in ustvari električni tok. Ta tok se začne pri anodi, kjer reducirne vrste oksidirajo in izgubijo elektrone.
Ti elektroni tečejo skozi električni prevodnik, ki ga poganja potencialna razlika, dokler ne dosežejo katode. Ko enkrat na površini katode, elektroni prehajajo na oksidantno vrsto, ga zmanjšajo in dokončajo redoks reakcijo.
Tako da se lahko pretok električne energije nadaljuje, ioni v raztopini ali staljena sol se premikajo iz ene elektrode na drugo. Kationi tečejo v katodo in anioni proti anodi.
Vam lahko služi: kemične reakcije vsakdanjega življenjaČeprav se zdi, da sta dva toka v nasprotnih smereh, v resnici oba toka gresta v isto smer. To je zato, ker imajo nosilci obremenitve, ki se premikajo v nasprotnih smereh.
Vrste elektrolitskih celic
Elektrolitne celice vodne raztopine
To so najpogostejše celice. Preprosto so sestavljeni iz dveh elektrod neke inertne kovine, potopljene v vodno raztopino soli, ki jo želimo predložiti elektrolizi.
Služijo le za zmanjšanje vrst, ki imajo bolj pozitiven potencial za zmanjšanje kot vodik, pod pogojem, da je pH nevtralen.
Po drugi strani pa služijo le za oksidacijo vrst, ki imajo oksidacijski potencial večji od moči vode, razen kisika.
Elektrolitične celice staljenih soli
V primerih, ko želimo. To zahteva posebno celico, kot je Downs -ova celica.
Uporaba elektrolitskih celic
Elektrolitične celice so v industriji zelo pomembne. Nekatere najpomembnejše aplikacije so:
Shranjevanje energije
Elektroliza omogoča pretvorbo energije električnega potenciala v potencialno kemično energijo. Zmanjšane in oksidirane vrste med procesom elektrolize postanejo nova vrsta, ki lahko spontano reagira, in sprosti energijo, ki je spet obrnjena.
Proizvodnja osnovnih halogenov
Halogeni so velikega industrijskega pomena. Vendar pa niso v naravi osnovno, saj so zelo reaktivne oksidacijske snovi. Zaradi tega se lahko mnogi halogeni pojavijo le z elektrolizo.
Vam lahko služi: faza razprševanjaČista proizvodnja kovin
Enako, kar lahko rečemo za halogene, lahko rečemo tudi o najbolj reaktivnih kovinah periodične tabele. Elemente, kot so alkalne in bakrene kovine, lahko dobimo le z elektrolizo staljenih soli in vodnih raztopin.
Primeri elektrolitskih celic v vsakdanjem življenju
Elektroliza natrijevega fluorida
Elektroliza natrijevega natrijevega natrijevega natrijevega natrijevega natrijevega fluorira se uporablja za proizvodnjo osnovnega natrija in fluora. Fluor lahko nato uporabimo za pridobivanje drugih manj reaktivnih halogenov.
Elektroliza bakrenega nitrata
V proizvodnji industrijskega bakra se to dobi z elektrolizo vodnih raztopin njegovih soli. Poleg tega baker očistimo tudi z elektrolizo, oksidacijo in raztapljanjem iz elektrode ter ga odlagamo v drugo.
Vodna elektroliza
Elektroliza vodne raztopine žveplove kisline razgradi kisik in vodikovo vodo in je eden najlažjih načinov za pridobitev tega zadnjega elementa v čisti obliki.
Reference
- Korint - splošna kemija. F.). Elektrolitične celice. Vzeti iz Korinta.Pucp.Edu.pe.
- Ecirana (s. F.). Elektrolitična celica. Vzeto iz ECURED.Cu.
- Luis Manuel (2014). Vrste elektrokemijskih celic. Vzeti iz prezi.com.
- Ustavi p., Yo. (2021). Kaj je elektrolitska celica? Vzeti iz jubraina.com.

