Lastnosti kisika, struktura, tveganja, uporabe

- 1398
- 181
- Don Nitzsche
On kisik Je kemični element, ki ga predstavlja simbol oz. Gre za zelo reaktivni plin, ki vodi skupino 16: kalkogeni. To ime je zato, ker sta žveplo in kisik prisotna v skoraj vseh mineralih.
Njegova visoka elektronegativnost pojasnjuje svojo veliko avidnost elektronov, kar vodi v kombiniranje z velikim številom elementov; Tako se pojavi širok razpon mineralnih oksidov, ki obogatijo Zemljino skorjo. Tako preostali kisik sestavlja in vzdušje diha.
 Kisik je običajno sinonim za zrak in vodo, vendar ga najdemo tudi v kamninah in mineralih. Vir: pxhere.
Kisik je običajno sinonim za zrak in vodo, vendar ga najdemo tudi v kamninah in mineralih. Vir: pxhere. Kisik je tretji element v vesolju, za vodikom in helijem in je tudi glavna masa sestavina Zemljine skorje. Ima odstotek volumna 20,8% zemeljske atmosfere in predstavlja 89% mase vode.
Običajno ima dve alotropni obliki: diatomski kisik (ali2), ki je najpogostejši način v naravi, in ozon (ali3), ki ga najdemo v stratosferi. Vendar obstajata še dva (oz4 jaz8), ki obstajajo v njegovi tekoči ali trdni fazi in pod velikimi pritiski.
Kisik se nenehno proizvaja s pomočjo fotosinteze, ki ga izvajajo fitoplankton in zemeljske rastline. Ko je proizveden, se sprosti tako, da ga lahko uporabljajo živa bitja, medtem ko se majhen del tega raztopi v morjih in podpira vodno življenje.
Zato je bistven element za živa bitja; Ne samo zato, ker je prisoten v večini spojin in molekul, ki jih tvorijo, ampak tudi posredujejo v vseh njihovih presnovnih procesih.
Čeprav se njegova izolacija pripiše Carlu Scheeleu in Josephu Priestleyju leta 1774, obstajajo znaki, da je bil kisik leta 1608 dejansko prvič izoliran, Michael Sendivogius.
Ta plin se uporablja v medicinski praksi za izboljšanje življenjskih pogojev bolnikov z dihalnimi težavami. Prav tako se kisik uporablja, da ljudem omogoča, da izpolnjujejo svoje funkcije v okoljih, v katerih se zmanjšuje ali ni dostopa do atmosferskega kisika.
Komercialno proizveden kisik se v glavnem uporablja v metalurški industriji za pretvorbo železa v jeklo.
[TOC]
Zgodovina
Duh dušika
Leta 1500 je Leonardo da Vinci, ki temelji na poskusih Philo de Byzantium, ki so bili v drugem stoletju. C., Ugotovil je, da je bil del zraka porabljen med izgorevanjem in dihanjem.
Leta 1608 je Cornelius Drebble pokazal, da grelna soba (srebrni nitrat, kno3) Plin se je zgodil. Ta plin je bil, kot bi bilo znano pozneje, kisik; Toda Drebble ga ni mogel prepoznati kot nov element.
Nato je leta 1668 John Majow poudaril, da je za ogenj odgovoren del zraka, ki ga je imenoval "Spiritus nitroaerus". Majow je opazil, da se snovi ne uredijo v odsotnosti dušika.
Majoow je opravil izgorevanje antimona in opazil povečanje teže antimona med svojim izgorevanjem. Nato je Majow ugotovil, da antimon v kombinaciji z dušilskim duhom.
Odkritje
Čeprav ni prejel priznanja od znanstvene skupnosti, je v življenju ali po njegovi smrti Michael Sandivogius (1604) verjetno pravi odkrivalec kisika.
Sandivogius je bil alkimist, filozof in švedski zdravnik, ki je ustvaril toplotno razgradnjo kalijevega nitrata. Njegovi poskusi so ga pripeljali do izdaje kisika, ki ga je imenoval "Cibus Vitae": Hrana življenja.
Med letoma 1771 in 1772 je švedski kemik Carl W Scheele ogrel več spojin: kalijev nitrat, manganov oksid in živosrebrni oksid. Scheele je opazil, da se je iz njih sprostil plin, ki je povečal zgorevanje, in do katerega je imenoval "Fire Air".
Joseph Priestly eksperimentira
Leta 1774 je angleški kemik Joseph Priestly ogrel živosrebrni oksid z uporabo dvanajst -palčnih leč, ki je koncentriral sončno svetlobo. Živosreni oksid je sprostil plin, zaradi katerega je sveča gorel veliko hitreje kot običajno.
Poleg tega je duhovnik preizkusil biološki učinek plina. Da bi to naredil, je v zaprto posodo postavil miško, za katero je pričakoval, da bo preživela petnajst minut; Vendar je v prisotnosti plina preživel eno uro, več, kot je ocenil.
Duhovniški rezultate je objavil leta 1774; Medtem ko je Scheele to storil leta 1775. Zaradi tega se običajno pripisuje odkritju kisika.
Kisik v zraku
Antoine Lavoisier, francoski kemik (1777).
Lavoisier je ugotovil, da je navidezno povečanje telesne mase, ki so ga imeli snovi med zgorevanjem, posledica izgube teže, ki se pojavi v zraku; Ker kisik v kombinaciji s temi snovmi in so zato ohranile množice reaktantov.
To je omogočilo Lavoisierju, da določi zakon o ohranjanju snovi. Lavoisier je predlagal ime kisika, ki je prišlo iz nastanka koren "oxys" kisline in "genov". Potem kisik pomeni "kislina".
To ime je napačno, saj vse kisline ne vsebujejo kisika; Na primer vodikove halogenide (HF, HCl, HBR in HI).
Dalton (1810) je vodni dodelil kemijsko formulo HO, zato je bila atomska teža kisika 8. Skupina kemikalij, vključno z: Davy (1812) in Berzelius (1814), je popravila Daltonov pristop in ugotovila, da je pravilna formula vode H2O in atomska teža kisika je 16.
Vam lahko služi: disionizirana vodaFizikalne in kemijske lastnosti
Videz
Brezbarven, stranišče in brez okusa plina; Medtem ko ima ozon vonj po hektarju. Kisik daje prednost izgorevanju, a samo po sebi ni gorivo.
 Tekoči kisik. Vir: Staff Sgt. Nika Glover, u.S. Letalske sile [javna domena]
Tekoči kisik. Vir: Staff Sgt. Nika Glover, u.S. Letalske sile [javna domena] V svoji tekoči obliki (zgornja slika) je bledo modra, njeni kristali pa so tudi modrikasti; Lahko pa pridobijo roza, oranžne in celo rdečkaste tone (kot bo razloženo v delu njegove strukture).
Atomska teža
15.999 u.
Atomsko število (z)
8.
Tališče
-218,79 ° C.
Vrelišče
-182.962 ° C.
Gostota
V normalnih pogojih: 1.429 g/l. Kisik je najgostejši plin kot zrak. Poleg tega je slab prevodnik toplote in električne energije. In na svoji vrelišču (tekočina) je gostota 1,141 g/ml.
Trojna točka
54.361 K in 0,1463 kPa (14,44 atm).
Kritična točka
154.581 K in 5.043 MPA (49770,54 ATM).
Fuzijska toplota
0,444 kJ/mol.
Toplota za uparjanje
6,82 kJ/mol.
Molarna kalorična sposobnost
29.378 J/(mol · k).
Parni tlak
Pri temperaturi 90 K ima tlačni tlak 986,92 atm.
Stanja oksidacije
-2, -1, +1, +2. Najpomembnejši status oksidacije je -2 (ali2-).
Elektronegativnost
3.44 na lestvici Pauling
Ionizacijska energija
Prvi: 1.313,9 kJ/mol.
Drugi: 3.388,3 kJ/mol.
Tretjič: 5.300,5 kJ/mol.
Magnetni vrstni red
Paramagnet.
Topnost vode
Topnost kisika v vodi se znižuje, ko se temperatura povečuje. Na primer: 14,6 ml kisika/L vode raztopimo na 0 ° C in 7,6 ml kisika/L vode pri 20 ° C. Topnost kisika v pitni vodi je večja kot v morski vodi.
V temperaturnem stanju 25 ° C in pri tlaku 101,3 kPa lahko pitna voda vsebuje 6,04 ml kisika/L vode; Medtem ko morska voda le 4,95 ml kisika/l vode.
Reaktivnost
Kisik je zelo reaktiven plin, ki reagira neposredno s skoraj vsemi elementi pri sobni temperaturi in visoki temperaturi; razen za kovine z večjimi redukcijskimi potenciali kot baker.
Lahko reagirate tudi s spojinami in oksidacijo elementov, ki so prisotni v njih. To se zgodi, ko na primer reagira z glukozo, da proizvaja vodo in ogljikov dioksid; ali kadar gori les ali ogljikovodik.
Kisik lahko sprejme elektrone s popolnim ali delnim prenosom, zato se šteje za oksidacijsko sredstvo.
Najpogostejša številka oksidacije ali stanje oksidacije je -2. S to oksidacijsko številko ga najdemo v vodi (h2O), žveplov dioksid (tako2) in ogljikov dioksid (CO2).
Tudi v organskih spojinah, kot so aldehidi, alkoholi, karboksilne kisline; skupne kisline, kot je h2SW4, H2Co3, Hno3; in v svojih izpeljanih soli: Na2SW4, Na2Co3 Ok ne3. V vseh njih je mogoče domnevati obstoj O2- (kar ne velja za organske spojine).
Oksidi
Kisik je prisoten kot oz2- V kristalnih strukturah kovinskih oksidov.
Po drugi strani pa v kovinskih superoksidih, kot je kalijev superoksid (KO2), kisik je podoben ionu oz2-. Medtem ko v kovinskih peroksidih rečem barijev peroksid (Bao2), kisik je predstavljen kot ion oz22- (Ba2+Tudi22-).
Izotopi
Kisik ima tri stabilne izotope: 16Ali z 99,76% številčnostjo; on 17Ali z 0,04%; in 18Ali z 0,20%. Upoštevajte, da je on 16Ali pa je daleč najbolj stabilen in obilen izotop.
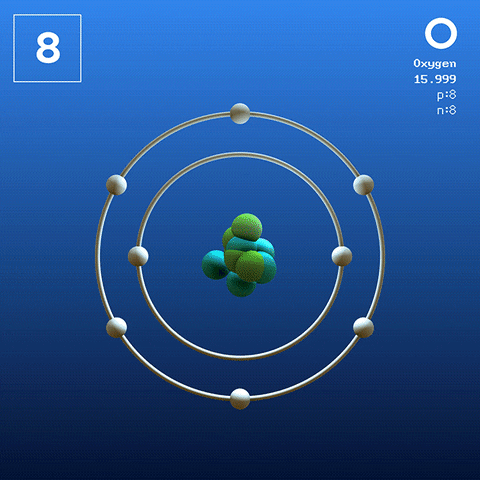
Elektronska struktura in konfiguracija
Molekula kisika in interakcije
 Diatomska molekula kisika. Vir: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Diatomska molekula kisika. Vir: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Kisik v bazalnem stanju je atom, katerega elektronska konfiguracija je:
[On] 2s2 2 p4
Glede na teorijo povezav Valencia (TEV) sta dva atoma kisika kovalentno povezana, tako da oba ločeno dokončata svoj oktet Valencia; Poleg tega, da se lahko parijo z dvema osamljenimi elektroni orbitale 2p.
Na ta način se pojavi diatomska molekula kisika, ali2 (Višja slika), ki ima dvojno vez (o = o). Njegova energetska stabilnost je taka, da kisika nikoli ne najdemo kot posamezni atomi v plinasti fazi, ampak kot molekule.
Ker o2 Je homonuklearni, linearni in simetričen, primanjkuje stalnega dipolnega trenutka; Zato so njene medmolekularne interakcije odvisne od njegove molekulske mase in londonskih disperzijskih sil. Te sile so razmeroma šibke za kisik, kar pojasnjuje, zakaj gre za plin v kopenskih pogojih.
Ko pa temperatura pade ali poveča tlak, molekule oz2 So prisiljeni v kohezivno; do te mere, da njihove interakcije postanejo pomembne in omogočajo nastanek tekočega ali trdnega kisika. Da bi jih poskušali razumeti molekularno, je treba izgubiti oč2 kot strukturna enota.
Ozon
Kisik lahko sprejme druge bistveno stabilne molekularne strukture; To pomeni, da ga najdemo v naravi (ali v laboratoriju) v različnih alotropnih oblikah. Ozon (spodnja slika) ali3, Na primer, je drugi alotrop najbolj znanega kisika.
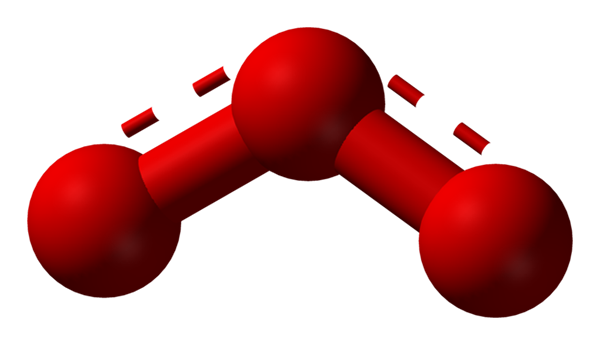 Struktura resonančnega hibrida, ki jo predstavlja model kroglic in palic za ozonsko molekulo. Vir: Ben Mills prek Wikipedije.
Struktura resonančnega hibrida, ki jo predstavlja model kroglic in palic za ozonsko molekulo. Vir: Ben Mills prek Wikipedije. Spet tev drži, razlaga in dokazuje, da je to v oz3 Obstajati morajo resonančne strukture, ki stabilizirajo pozitivno formalno obremenitev sredinskega kisika (črte, pikčane v rdeči barvi); Medtem ko se kisik s konca bumeranga porazdeli negativna obremenitev, kar povzroči skupno obremenitev za ozon.
Lahko vam služi: Pravila topnosti: Splošni vidiki in pravilaNa ta način povezave niso preproste, ne pa dvojne. Primeri resonančnih hibridov so zelo pogosti pri toliko molekulah ali anorganskih ionih.
O2 jaz3, Kot rezultat, da so njihove molekularne strukture drugačne, enako velja za njihove fizikalne in kemijske lastnosti, tekoče ali kristalne faze (tudi če oba porabita kisikove atoma). Teoretizirajo, da je sinteza na velikih lestvicah cikličnega ozona verjetno, katerih struktura spominja na rdečkasto in oksigenirano trikotnik.
Zaenkrat prispejo "običajni alotropi" kisika. Vendar morata upoštevati še dva: o4 jaz8, najdeno ali predlagano v tekočem in trdnem kisiku.
Tekoči kisik
Plinasti kisik je brezbarven, ko pa se temperatura spusti na -183 ° C, se kondenzira v bledo modri tekočini (nebesna podobna). Interakcije med molekulami oz2 Zdaj lahko tudi njihovi elektroni absorbirajo fotone v rdečem območju vidnega spektra, da odražajo njegovo značilno modro barvo.
Vendar je bilo teoretično, da je v tej tekočini več kot preproste molekule oz2, pa tudi molekula oz4 (spodnja slika). Zdi se, kot da je ozon "zataknil" še en atom kisika, ki je nekako posredoval novo opisano formalno tovoranje.
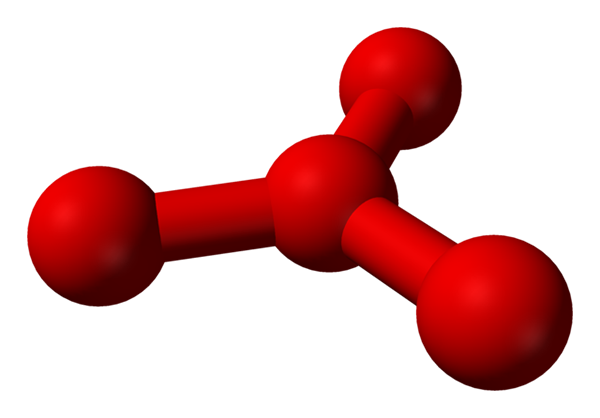 Model predlagana struktura s kroglami in palicami za molekulo tetraoksika. Vir: Benjah-BMM27 [javna domena]
Model predlagana struktura s kroglami in palicami za molekulo tetraoksika. Vir: Benjah-BMM27 [javna domena] Težava je v tem, da je v skladu z računalniškimi in molekularnimi simulacijami omenjena struktura za O4 Ni ravno stabilen; Vendar napovedujejo, da obstajajo kot enote (ali2)2, to je dve molekuli O2 Tako se približajo, da tvorijo nekakšen nepravilen okvir (atomi ali niso poravnani med seboj).
Trden kisik
Ko se temperatura spusti na -218,79 ° C, se kisik kristalizira v preprosti kubični strukturi (γ faza). Ker temperatura še bolj pade, kubično steklo trpi prehod na β faze (Rhomboédica in pri -229,35 ° C) in α (monoklinic in pri -249,35 ° C).
Vse te kristalne faze trdnega kisika se pojavijo pri tlaku v okolju (1 atm). Ko se tlak poveča na 9 GPa (~ 9000 atm), se pojavi Δ faza, katere kristali so oranžni. Če se tlak še naprej povečuje na 10 GPa, se pojavi rdeči trdni kisik ali faza ε (spet monoklinično).
Faza ε je posebna, ker je tlak tako velik, da molekule oz2 Ne le, da jih sprejmejo kot enote oz4, pa tudi oz8:
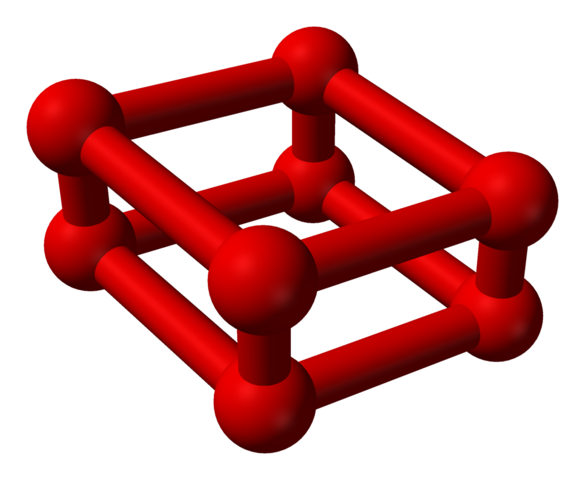 Modelna struktura s kroglami in palicami za molekulo oktaksika. Vir: Benjah-BMM27 [javna domena]
Modelna struktura s kroglami in palicami za molekulo oktaksika. Vir: Benjah-BMM27 [javna domena] Upoštevajte, da to oz8 Sestavljen je iz dveh enot oz4 kjer je že pojasnjen nepravilen okvir. Prav tako je veljavno obravnavati kot štiri oz2 tesno poravnan in v navpičnih položajih. Vendar je njegova stabilnost takšna pod tem pritiskom, da oz4 jaz8 Sta dva dodatna alotropa za kisik.
In končno imamo fazo ζ, kovinsko (za pritiske, večje od 96 GPa), pri katerem tlak naredi elektrone, razpršene v kozarcu; Kot pri kovinah.
Kje je in proizvodnja
Minerali
Kisik je v masi, tretji element vesolja, za vodikom in helijem. Predstavlja najpogostejši element Zemljine skorje, ki predstavlja približno 50% njegove mase. V glavnem je v kombinaciji s silicijem v obliki silicijevega oksida (SIO2).
Kisik je del nešteto mineralov. Prav tako se nahaja kot del številnih spojin, kot so karbonati, fosfati, sulfati, nitrati itd.
Zrak
Kisik predstavlja 20,8% atmosferskega zraka v prostornini. V troposferi je predvsem kot diatomska molekula kisika. Medtem ko je v stratosferi plinasta plast med 15 in 50 km zemeljske površine, je kot ozon.
Ozon nastaja z električnim šokom na molekuli O2. Ta alotrop kisika absorbira ultravijolično svetlobo sončnega sevanja in blokira njegovo škodljivo delovanje na ljudi, kar je v skrajnih primerih povezano z pojavom melanomov.
Sveža in slana voda
Kisik je glavni sestavni del morske vode in sladke vode iz jezer, rek in podzemne vode. Kisik je del kemijske formule vode, ki masi 89%.
Čeprav je topnost kisika v vodi razmeroma nizka, je količina kisika, raztopljenega v tem, bistvena za vodno življenje, ki vključuje številne vrste živali in alg.
Živa bitja
Človek se oblikuje, približno 60% vode in hkrati bogato s kisikom. Poleg tega je kisik del številnih spojin, kot so fosfati, karbonati, karboksilne kisline, ketone itd., ki so bistveni za življenje.
Kisik je prisoten tudi v polisaharidih, lipidih, beljakovinah in nukleinskih kislinah; Se pravi, tako imenovane biološke makromolekule.
Je tudi del škodljivih odpadkov človekove aktivnosti, na primer: ogljikov dioksid in dioksid, pa tudi žveplov dioksid.
Biološka proizvodnja
 Rastline so odgovorne za obogatitev kisikovega zraka v zameno za ogljikov dioksid, ki izdihnemo. Vir: Pexels.
Rastline so odgovorne za obogatitev kisikovega zraka v zameno za ogljikov dioksid, ki izdihnemo. Vir: Pexels. Kisik se pojavi med fotosintezo, pri katerem morske fitoplanktonske in kopenske rastline uporabljajo svetlobno energijo za reagiranje ogljikovega dioksida z vodo, kar povzroča glukozo in sprošča kisik.
Ocenjujejo, da je več kot 55% kisika, ki ga proizvaja fotosinteza, posledica delovanja morske fitoplanktona. Zato predstavlja glavni vir generacije kisika na zemlji in je odgovoren za vzdrževanje življenja v njem.
Industrijska proizvodnja
Utekočinjenje zraka
Glavna metoda proizvodnje industrijskega kisika se ustvari leta 1895, neodvisno pa jih Karl Paul Gottfried von Linde in William Hamson. Ta metoda trenutno uporablja nekatere spremembe.
Vam lahko služi: butanone: struktura, lastnosti in uporabePostopek se začne s stiskanjem zraka, da kondenzira vodno paro in ga tako odpravi. Nato se zrak preseli, ko ga izvede mešanica zeolita in silikagela, za izločanje ogljikovih dioksida, težkih ogljikovodikov in preostale vode.
Nato se komponente tekočega zraka ločijo skozi delno destilacijo, pri čemer dosežemo ločitev plinov, ki so prisotni v različnih vreliščih. S to metodo dobimo kisik z 99% čistostjo.
Vodna elektroliza
Kisik nastaja z visoko očiščeno vodno elektrolizo in z električno prevodnostjo, ki ne presega 1 µs/cm. Voda je ločena z elektrolizo v njegovih komponentah. Vodik, ko se kation premakne na katodo (-); Medtem ko se kisik premakne proti anodi (+).
Elektrode imajo posebno strukturo za zbiranje plinov in posledično proizvede.
Toplotna razgradnja
Toplotna razgradnja spojin, kot sta živosrebrni oksid in gostitelj (kalijev nitrat), sprošča kisik, ki ga je mogoče zbrati za uporabo. V ta namen se uporabljajo tudi peroksidi.
Biološki papir
Kisik proizvaja fitoplankton in kopenske rastline s pomočjo fotosinteze. Prečka pljučno steno in v krvi ga zajame hemoglobin, ki ga prevaža v različne organe in nato uporabi pri celični presnovi.
V tem procesu se kisik uporablja med presnovo ogljikovih hidratov, maščobnih kislin in aminokislin, da na koncu proizvajajo ogljikov dioksid in energijo.
Dihanje lahko shematizira na naslednji način:
C6H12Tudi6 + Tudi2 => Co2 + H2Ali +energija
Glukoza se presnavlja v naboru zaporednih kemičnih procesov, ki vključuje glikolizo, KREBS cikel, elektronsko transportno verigo in oksidativno fosforilacijo. Ta niz dogodkov proizvaja energijo, ki se nabira kot ATP (Adenosín Triposfat).
ATP se uporablja v različnih procesih v celicah, ki vključuje transport ionov in drugih snovi skozi plazemsko membrano; črevesna absorpcija snovi; krčenje različnih mišičnih celic; Presnova različnih molekul itd.
Polimorfonuklearni in makrofagi levkociti so fagocitne celice, ki lahko uporabljajo kisik za proizvodnjo superoksidnega iona, vodikovega peroksida in posameznega kisika, ki se uporabljajo za uničenje mikroorganizmov.
Tveganja
Dihanje kisika do visokih pritiskov lahko povzroči slabost, omotico, mišične krče, izgubo vida, napade in izgubo zavesti. Poleg tega dihanje čistega kisika za daljše obdobje povzroča pljučno draženje, ki se kaže s kašljem in skrajšanjem dihanja.
To je lahko tudi vzrok za nastanek pljučnega edema: zelo resno stanje, ki omejuje dihalno funkcijo.
Vzdušje z visoko koncentracijo kisika je lahko nevarno, saj olajša razvoj požarov in eksplozij.
Prijave
Zdravniki
Kisik se daje bolnikom, ki imajo dihalno odpoved; Takšen je primer bolnikov, ki jih vplivajo pljučnica, pljučni edem ali emfizem. Niso mogli dihati okoljskega kisika, saj bi bili resno prizadeti.
Bolniki s srčnim popuščanjem v tem, kar je predstavljeno, akumulacija tekočine v alveolih potrebujejo tudi kisik; Kot bolniki, ki so utrpeli hudo vaskularno nesrečo (možganska kap).
Poklicne potrebe
Gasilci, ki se v okolju z neprimernim prezračevanjem borijo z ognjem, zahtevajo uporabo mask in steklenic s kisikom, ki jim omogočajo, da izpolnjujejo svoje funkcije, ne da bi svoje življenje postavili v večje tveganje.
Podmornice so opremljene z opremo za proizvodnjo kisika, ki mornarjem omogoča bivanje v zaprtem okolju brez atmosferskega dostopa do zraka.
Potapljači opravljajo svoje delo, potopljeno v vodo in zato izolirano iz atmosferskega zraka. Dihajo s kisikom, ki ga črpajo cevi, povezane s svojim skeniranjem, ali uporaba bombonov, pritrjenih na telo podmornice.
Astronavti izvajajo svoje dejavnosti v okoljih, opremljenih s generatorji kisika, ki omogočajo preživetje med vesoljskimi potovanji in na vesoljski postaji.
Industrijsko
Pri pretvorbi železa v jeklo porabi več kot 50% industrijsko proizvedenega kisika. Lito železo se vbrizga s kisikovim curkom, da se odpravi prisotni žveplo in ogljik; reagirati tako, da proizvajajo tako pline2 in co2, oziroma.
Acetilen se uporablja v kombinaciji s kisikom za rezanje kovinskih plošč in tudi za izdelavo njenega varjenja. Kisik se uporablja tudi pri proizvodnji stekla, kar povečuje izgorevanje pri peki za izboljšanje njegove preglednosti.
Atomska absorpcijska spektrofotometrija
Kombinacija acetilena in kisika se uporablja za izgorevanje vzorcev različnih izvora v atomskem absorpcijskem spektrofotometru.
Med postopkom na žarek svetilke vpliva plamen, ki je značilen za želeni element. Plamen absorbira svetlobo svetilke, kar omogoča količinsko določitev elementa.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Kisik. Pridobljeno iz: v.Wikipedija.org
- Richard Van Noordden. (13. september 2006). Samo lepa faza? Trdno rdeči kisik: neuporaben, a prijeten. Okrevano od: Narava.com
- Azonano. (4. december 2006). Trden kisik e-fazni kristalni struktura, določena vzdolž odkrivanja grozda kisika O8. Okreval od: Azonano.com
- Nacionalni center za informacije o biotehnologiji. (2019). Molekula kisika. Baza podatkov Pubchem. Cid = 977. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Doktor. Doug Stewart. (2019). Dejstva o kisikovih elementih. Kemikool. Okrevano od: Chemicool.com
- Robert c. Drzen. (9. julij 2019). Kisik: kemični element. Encyclopædia Britannica. Okrevano od: Britannica.com
- Wiki otroci. (2019). Družina kisika: lastnosti via elementov. Okrevano od: preprosto.Znanost
- ADVAMEG, INC. (2019). Kisik. Okreval od: Makehow.com
- Lentech b.V. (2019). Tabela obdobja: kisik. Okrevano od: Lentech.com
- Ministrstvo za zdravje in starejše storitve New Jerseyja. (2007). Kisik: Shema nevarnih snovi. [PDF]. Okreval od: NJ.Gov
- Yamel Mattarollo. (26. avgust 2015). Industrijske kisikove industrijske aplikacije. Okreval od: altecdust.com
- « Neonska zgodovina, lastnosti, struktura, tveganja, uporabe
- Značilnosti histidina, struktura, funkcije, hrana »

