Značilnosti histidina, struktura, funkcije, hrana
- 2074
- 244
- Adrian Legros
The Histidin (Njegov, h) To je aminokislina, ki se uporablja za sintezo beljakovin. Gre za hidrofilno molekulo, zato je na splošno usmerjena proti zunanji strani beljakovinskih struktur, ko so v tekočem mediju.
Velja za bistveno aminokislino za odraščajoče otroke, saj je ne proizvajajo. Pri odrasli je majhna proizvodnja histidina, vendar ni dovolj za zagotavljanje dnevnih potreb.
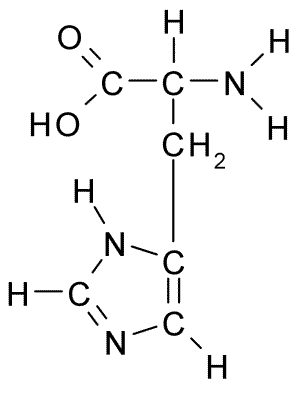
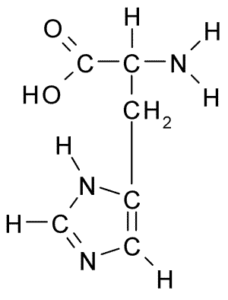 Kemična struktura aminokisline histidin (vir: BORB, prek Wikimedia Commons)
Kemična struktura aminokisline histidin (vir: BORB, prek Wikimedia Commons) Za živali in človeka je histidin bistvena ali vsaj pol -pomembna aminokislina, vendar rastline, glive in mikroorganizmi učinkovito proizvajajo histidin, ki ga potrebujejo, in so del prehranskih virov histidina, poleg beljakovinskih živali.
Histidin izpolnjuje zelo pomembne fiziološke funkcije pri človeku, kot so: tiste, ki so del aktivnih središč številnih encimov, med drugim sodelujejo v rasti, imunskem sistemu in v nastajanju mielina v živčnih vlaknih.
Biosinteza histidina je zapleten proces, ki poteka predvsem v jetrih in zahteva 9 do 11 encimskih korakov. Njegova razgradnja se pojavi v jetrih in koži in gre skozi tvorbo glutamata, nato po različnih poteh.
Veliko živil je bogato s histidinom, kot so živalski beljakovine, kot so meso in mlečni izdelki, pa tudi rastlinske beljakovine. Te zagotavljajo veliko dnevnih potreb po histidinu, ki jih mora naše telo pravilno delovati.
Primanjkljaj ali presežek histidina, ki ga povzročajo dedovanje presnovnih ali prevoznih težav ali prehranske okvare v vnosu, je povezan z nekaterimi pomembnimi težavami, ki vplivajo na zdravje tako pri otrocih kot pri odraslih. Zadostna poraba histidina vam omogoča ohranjanje zdravega in zdravega življenja v večini primerov.
[TOC]
Značilnosti
Poudarjanje značilnosti histidina je, da ga je mogoče pretvoriti v histamin, snov, ki aktivno sodeluje v številnih alergijskih in vnetnih reakcijah.
V ribah, ki so izpostavljene okolju brez zadostnega hlajenja, lahko bakterije pretvorijo histidin v histamin in zato pri zaužitju povzročajo zastrupitev s hrano.
Druga značilnost te aminokisline je, da je ena redkih, med obstoječimi 22.4) Je ioniziran in zato lahko aktivno sodeluje na katalitičnem mestu številnih encimov.
V molekuli hemoglobina je proksimalni histidin eden izmed hemo skupinskih ligandov. Z drugimi besedami, ta aminokislina sodeluje v funkciji transporta kisika hemoglobina in je nepogrešljiva za sintezo tega proteina, pa tudi za mioglobin, ki je znan tudi kot "mišični hemoglobin".
Struktura
Histidin je aminokislina Hidrofilni polar bistvenega pomena, razvrščena v esencialne aminokisline, saj ga živali ne morejo sintetizirati. Vendar pa ga, kot je bilo že omenjeno, sintetizirajo bakterije, glive in rastline.
Pri odraščajočih otrocih je histidin nujno potreben; Odrasla oseba ga lahko sintetizira, vendar ni jasno, ali to zajema dnevne potrebe histidina, zato jo je treba zaužiti s prehrano.
Kot vse aminokisline ima tudi histidin ogljik, na katerega se pridruži amino skupina, karboksilna skupina, vodikov atom in stranska veriga.
Vam lahko služi: coxiella burnetiiBočna veriga te aminokisline tvori imidazolni obroč, ki za fiziološki pH protone in pridobi pozitivno obremenitev in se imenuje "Imidazolio " skrajšano kot IMH+.
Skupaj z lizinom in argininom histidin tvori skupino osnovnih aminokislin. Od treh je histidin najmanj osnovni, njegov obroč imididoólica.
Ker fiziološki pH histidin lahko izmenja protone, to običajno sodeluje pri encimski katalizi, ki vključuje prenos protonov. Poleg tega, ker gre za polarno aminokislino, ga običajno najdemo na zunanji površini beljakovin, kjer se lahko hidrira v vodnem mediju.
Funkcije
Kot del aktivnega encimskega mesta
Histidin je potreben za sintezo številnih beljakovin, zlasti encimov, katerih aktivna središča imajo to aminokislino. Je del aktivnega središča aldlasaz sesalcev, kjer deluje kot protonski darovalec.
Nahaja se v aktivnem središču karboksipeptidaze A, encimu trebušne slinavke, ki ima aktivno mesto, ki ga tvorita Zn in histidin. V glikolitičnem encimu Mutasa fosfoglicerat sta v njenem aktivnem centru dva odpadka histidina, ki delujeta kot sprejemniki ali darovalci fosforilnih skupin.
Najdemo ga tudi na aktivnem mestu encimov, kot so gliceraldehid 3-fosfat dehidrogenaza, laktat dehidrogenaza, papain, himotripsin, RNASA A in amonijak liasa histidin (histidaza). Poleg tega je zaviralec encimske glutaminske sintetaze.
Druge funkcije
Ta aminokislina je zelo pomembna za organizem, saj je dekarboksilaza histidin decarn.
Histidin proizvajajo nevroni centralnega živčnega sistema z nevromodulatornimi funkcijami.
Potrebno je za nastajanje mielinskih strok živčnih vlaken, zato izpolnjuje pomembno vlogo pri prenosu električnih impulzov v njih.
Skupaj z rastnim hormonom in drugimi aminokislinami histidin prispeva k mehanizmom za popravilo tkiv, predvsem v srčno -žilnem sistemu.
Nekatere dodatne funkcije vključujejo:
- Prispeva z razstrupljanjem nekaterih težkih kovin, saj deluje kot kelatiranje.
- Ščiti pred poškodbami, ki jih povzroča sevanje.
- Sodelujte pri tvorbi rdečih in belih krvnih celic.
- Potrebno je za tvorbo hemoglobina.
- Pomaga pri boju z nekaterimi negativnimi učinki revmatoidnega artritisa, kot sta vnetje in pomanjkanje mobilnosti.
- Je pomembna aminokislina za regeneracijo kapilar, rast in spolno funkcijo.
Karnozin, anserine in homokozin, so dipéptidi, ki nastanejo iz histidina. Prva dva najdemo v mišicah in imata pomembne funkcije, kot so tamponerji in kot aktivatorji miozina Atasa.
Homokozin nastaja v možganih v količinah 100 -krat večje od mesnatih skeletnih mišic.
Biosinteza
Histidin pridobi svoje gazirano okostje iz 5-fosfatnega riboza. V bakterijah In. Coli, Ta aminokislina se pojavlja iz omenjene spojine z 11 encimskimi koraki:
- Prvi korak sinteze je v prenosu fosforibozila iz ATP v ogljik 1 5-fosfatnega riboza, ki ustvarja 5-fosforribosil-1-pirofosfat (prpp) (prpp). Encim fosforibosil-pirofosfat sintetizara (PRPP sintetična) katalizira to reakcijo.
- Nato pride do prenosa ogljikove pirofosfatne skupine 1 na N-1 ATP in se pojavi N1- (5'-fosforribosil) -ATP. Encim, ki katalizira to reakcijo, je ATP fosforuseltransferaza.
- Z delovanjem fosforibosil-top-pirofosfat hidroksilaze α, β-piofosfat povezava ATP je hidroksilaza in N1- se tvori (5'-fosforribosil) -Amp.
- Encim fosforibozil-map hidroksilaza odpre purinski obroč med N-1 in C-6, ribonukleotid.
- Nato se odpira obroč ribofuranosa, ki prihaja iz prpp-a in je izomeriziran do ketoze, ki tvori N1- (5'-fosforibosil formimin) -5-aminoimidazol-4-karboksamid-1-libonukleotid z učinkom izomeraznega encime.
- Encim aminotransferaze prenaša v skupino glutamina, ki postane glutamat, in razbije oblikovalno povezavo, zato se sprosti 5-aminoimidazol-karboksamid-1-libonukleotid in imidazol-glicerol fosfat se ustvari.
- Molekula vode imidazol-glicerola fosfata se izloči s pomočjo imidazol-glicerol fosfata dehidrataze in tvori imidazol-acetol fosfat.
- Fosfat imidazola-acetola prenaša amino skupino s histidinol transaminaznim fosfatom in nastane fosfat histidinol.
- Fosforična skupina ester histidinol fosfata, ki tvori histidinol, je hidrolizirana. Histidinol fosfat fospataza katalizira to reakcijo.
- Kasneje se histidinol oksidira s histidinol dehidrogenazo in je histidinalna.
- Isti histidinol dehidrogenaza oksidira v histidinalni in naredi histidin.
Prvi encim biosintetske poti histidina zavira produkt poti, to je, da histidin sodeluje pri alestrični inhibiciji ATP fosforibosiltransferaze, ki predstavlja glavni mehanizem regulacije poti.
Degradacija
Histidin, prolin, glutamat, arginin in glutamin so aminokisline, ki, ko na koncu tvorijo α-zotoglurat. Štirje od njih najprej postanejo glutamat, ki zaradi transaminacije povzroči α-ketoglutart.
Histidin s histidinazo izgubi skupino α-amino, da postane Urocanato. Nato urocanaza vlaži položaje 1 in 4 urocanato, ki tvori 4-midazolon-5-propionat. Nato se pojavi imino skupina 4-midazolona-5-propionato, ki tvori n-forminoglutamato.
Zadnja reakcija pomeni prenos formala iz N-forminoglutamata na tetrahidrofolat, ki deluje z encimskim glutamatom. Končni produkti te reakcije so glutamat in N5-formimino tetrahidrofolat.
Α-ketoglutarat nastane s transaminacijo glutamata. Α-ketoglutarat je posrednik KREBS cikla in lahko vstopi tudi v glukoneogeno pot za tvorbo glukoze.
Skupina Glutamato Amino vstopi v cikel proizvodnje sečnine, ki jo je treba izločiti z urinom. Vse te reakcije se pojavljajo v jetrih in del njih na koži.
Živila, bogata s histidinom
Dnevne potrebe po histidinu so približno 10 do 11 mg na kg telesne teže, na dan. Pri odraščajočih otrocih je histidin bistvena aminokislina, ki jo je treba dobaviti s prehrano.
Pri drugih živalih je histidin tudi bistvena aminokislina in tisti, ki so vzgojeni v hlevu.
Med živili, bogato s histidinom, so:
- Govedina, jagnjetina, svinjina, piščanec in puran. Najdemo ga tudi pri ribah, kot so tuna (tudi v konzerviranju), lososa, postrvi, pargom in Lubina, pa tudi v nekaterih morskih sadežih.
Lahko vam služi: Krvna kultura: za kaj je, fundacija, postopek, rezultati- Mleko in njegovi derivati, zlasti pri dozorelih sirih, kot so parmezan, Gruyere, švicarski sir, gouda, med drugim. V domorodcih, v serumu, v jogurtu in v kisli kremi.
- Soja in oreščki, kot so oreščki in semena. V sončničnici, buči, lubenici, sezamu, mandljih, pistacijah, arašidovem maslu in chia.
- Jajca in fižol ali beli fižol.
- Polnozrnata žita, kot so kvinoja, pšenica, integralni riž itd.
Prednosti vašega vnosa
Obstajajo številni patološki pogoji, v katerih je histidin lahko uporaben kot adjuvant za zdravljenje.
Med temi patologiji lahko poimenujemo revmatoidni artritis, arterijsko hipertenzijo (ker je opisan hipotenziven učinek histidina), pri okužbah, hladnem in slušnju, razjedah in anemijih.
Na koži razgradnja zaužita histidin povzroči urokansko kislino, ki je sposobna zaščititi kožo, saj absorbira ultravijolične žarke.
Prekomerna poraba zdravih posameznikov ne povzroča večjih sprememb, saj se hitro poslabša. Vendar je treba omejiti uporabo prehranskih dopolnil histidina pri bolnikih s hudimi težavami jeter in/ali ledvic.
Motnje pomanjkanja
Primanjkljaj histidina je povezan s spremembami v imunskem odzivu.
Poročali so tudi o težavah s kostmi, gluhosti in anemiji, povezanimi s pomanjkanjem histidina.
Hartnup -ova bolezen je dedno stanje, ki prizadene transport histidina in triptofana skozi sluznico tankega črevesa in ledvic, kar povzroči primanjkljaj obeh aminokislin.
Najpomembnejše klinične manifestacije so pojav shegoznih in rdečih lezij na koži po izpostavljenosti soncu, različne stopnje sprememb gibanja in nekateri simptomi psihiatričnih bolezni.
Histidinemija je avtosomska recesivna bolezen, za katero je značilen primanjkljaj encima histidaze, kar povzroča povečanje koncentracij histidina v krvi in urinu.
Posledično ti bolniki ne morejo razgraditi histidina na urokalno kislino v jetrih in koži. To bolezen spremljajo zmerna duševna zaostalost, okvare govora in slušni spomin brez gluhosti.
Omejitev vnosa histidina kot zdravljenja ni bila učinkovita pri ustvarjanju kliničnega izboljšanja in pomeni tveganje za ustvarjanje motenj rasti pri otrocih, ki jih je prizadela ta bolezen.
Reference
- Mathews, c., Van Holde, k., & Ahern, k. (2000). Biokemija (3. izd.). San Francisco, Kalifornija: Pearson.
- Murray, r., Bender, d., Botham, k., Kennelly, str., Rodwell, v., & Weil, P. (2009). Harperjeva ilustrirana biokemija (28. izd.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Lehningerjeva načela biokemije. Omega izdaje (5. izd.). doi.org
- Perecarz, str., Farri, l., & Papageorgiou, a. (1983). Učinki formul iz človeškega mleka in nizkih beljakovin na hitrost celotnega premika telesnih beljakovin in 3-metilhistidina urina pri prezgodnji dojenčki. Klinična znanost, 64, 611-616.
- Pesem, b. C., Joo, n., Aldini, g., & Yeum, k. (2014). Biološka funkcija histidin-dipeptidov in presnovnega sindroma. Prehranske raziskave in praksa, 8(1), 3-10.
- « Lastnosti kisika, struktura, tveganja, uporabe
- Zgodovina, značilnosti strokovnih sistemov, prednosti, slabosti »

