Struktura natrijevega oksalata (NA2C2O4), lastnosti, uporabe, tveganja

- 1805
- 416
- Adrian Legros
On natrijev oksalat Gre za organsko spojino, ki jo tvorita dva natrijeva iona in oksalatni ion. Njegova kemična formula je na2C2Tudi4 ali tudi na2(COO)2. Je natrijeva sol oksalne kisline ali etanodionske kisline. Na2C2Tudi4 Je kristalna bela trdna snov in njene vodne raztopine so osnovne (alkalne).
Natrijev oksalat je prisoten v rastlinah in zelenjavi. Pri človeku se naravno nastaja iz konjugirane kislinske oksalne kisline, ki jo posledično proizvajajo nekateri presnovni procesi.
 Natrijev oksalat NA2(COO)2 trden. Lem [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Natrijev oksalat NA2(COO)2 trden. Lem [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Na2C2Tudi4 Uporablja se v laboratorijih za kemijsko analizo kot reducirajočega sredstva (nasprotno od oksidanta). Tudi omogočiti teste nekaterih organskih spojin med čiščenjem odpadne vode.
Uporablja se za izločanje odpadkov klorofluoroogljikovodikov (CGC), ki poškodujejo ozonsko plast. Prav tako je surovina pridobivanje oksalne kisline na ekonomičen način.
Zaradi visoke vsebnosti natrijevega oksalata v nekaterih užitnih zelenjavi bi se morali ljudje, ki imajo nagnjenost k oblikovanju izračunov ali ledvičnih kamnov. To je zato, ker kamni na splošno oblikujejo z oksalati.
[TOC]
Struktura
Natrijev oksalat sestavljata dva natrijeva kationa+ in oksalatni anion (COO)22-. Oksalatni anion nastajata dva COO- združena skozi dva ogljikova atoma: -OOC-COO-.
V trdnem natrijevem oksalatu ima oksalat anion ravno obliko. To pomeni, da v isti ravnini najdemo tako ogljikove kot kisik.
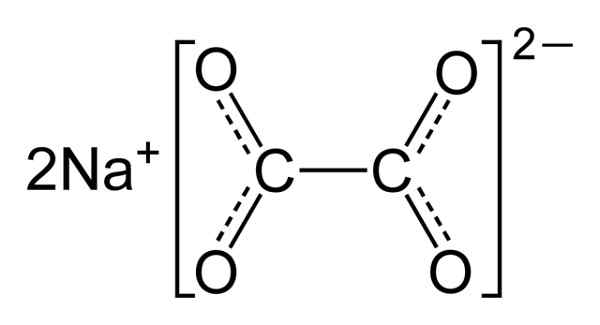 Kemična struktura natrijevega oksalata2(COO)2. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
Kemična struktura natrijevega oksalata2(COO)2. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Nomenklatura
- Natrijev oksalat
- Dysodio Oxalat
- Natrijeva sol etanodionske kisline
Lastnosti
Fizično stanje
Kristalno bela trdna trdna snov.
Molekularna teža
134,0 g/mol
Gostota
2,27 g/cm3 pri 20 ° C.
Topnost
Voda topna: 3,7 g/100 ml pri 20 ° C.
ph
Njegove vodne raztopine so osnovne (alkalne), ker oksalatni anion ponavadi jemljejo vodne protone, ki zapuščajo ione Oh brezplačno-.
Vam lahko služi: Neon: Zgodovina, lastnosti, struktura, tveganja, uporabeKemične lastnosti
Lahko nevtralizira kisline in reakcije so eksotermične, to je, da oddajajo toploto.
Služi kot reducirajoče sredstvo in v teh reakcijah ustvarja ogljikov dioksid2.
Ima lastnost, da se pridruži več kovinskim ioni, kot je vera železnih železov2+ in železova vera3+.
Pridobivanje
Po posvetovalnem viru lahko natrijev oksalat dobimo oksidacijo kisika ali2 pri temperaturi približno 250 ° C v koncentrirani raztopini NaOH natrijevega hidroksida.
Prisotnost v naravi
Natrijev oksalat je prisoten v številnih rastlinah in zelenjavi, kot so chard, špinača in ruibarbo, in v zrnih, kot so soja, med številnimi drugimi rastlinskimi izdelki.
 Špinača ima veliko natrijevega oksalata. Avtor: Aline Ponce. Vir: Pixabay.
Špinača ima veliko natrijevega oksalata. Avtor: Aline Ponce. Vir: Pixabay. Njegova konjugirana kislinska oksalna kislina se v človeškem organizmu pojavi s presnovo glikolne kisline ali askorbinske kisline. Ko se proizvede, se ne presnavlja, ampak ga izloča urin v obliki oksalata.
 Ruibarbo vsebuje natrijev oksalat. Avtorji: s. Hermann & F. Richter. Vir: Pixabay.
Ruibarbo vsebuje natrijev oksalat. Avtorji: s. Hermann & F. Richter. Vir: Pixabay. Prijave
V laboratorijih za kemijske analize
Uporablja se kot kemični reagent, običajno kot reducirajoči sredstvo, na primer za standardizacijo raztopin kalijevega permanganata, to je natančno določitev, koliko natrijevega permanganata imajo.
V uničenju klorofluoroogljikov
Natrijev oksalat se uporablja za uničenje klorofluoroogljikov (CFC). Te spojine CFC so bile ena tistih, ki so odgovorni za uničenje ozonske planeta planeta (ki nas ščiti pred ultravijoličnim sevanjem).
Leta 1996 so nekateri raziskovalci predlagali uporabo natrijevega oksalata za njihovo odpravo, saj zlahka reagira s CFC pri temperaturah 270-290 ° C, zaradi česar so neškodljivi proizvodi proti ozonski plasti.
Reakcijo natrijevega oksalata s CFC -ji lahko nadzorujemo, da dobimo halogenirane aromatične ogljikovodike, ki niso škodljivi za ozonsko plast, vendar so uporabne spojine v kemični industriji.
Lahko vam služi: propilen glikol: struktura, lastnosti, sinteza in uporabeTo reakcijo lahko dosežemo tudi do maksimuma in celoten CFC pretvorimo v NAF natrijev fluorid, solski natrijev klorid, osnovni ogljik in ogljikov dioksid CO2.
 Ozonska planeta planeta nas ščiti pred ultravijoličnimi žarki sonca. Natrijev oksalat vam omogoča, da odpravite spojine CFC, ki ga poškodujejo. Avtor: One94. Vir: Pixabay.
Ozonska planeta planeta nas ščiti pred ultravijoličnimi žarki sonca. Natrijev oksalat vam omogoča, da odpravite spojine CFC, ki ga poškodujejo. Avtor: One94. Vir: Pixabay. Pri določanju pomembnih parametrov pri čiščenju odpadne vode
Ugotovljeno je bilo, da je natrijev oksalat koristen za merjenje količine in razredov organskih spojin, ki izločajo mikroorganizme blata, ki se uporabljajo za zdravljenje odpadne vode.
Ukrep takšnih spojin je pomemben za določitev njihove funkcije med čiščenjem odpadne vode, saj je enostavnost ločevanja blata od vode odvisna od njih.
Z uporabo natrijevega oksalata se izogibamo neprijetnostim drugih metodah.
Za pridobitev oksalne kisline
Surovi natrijev oksalat iz odpadkov iz določenih procesov je bil uporabljen za proizvodnjo oksalne kisline H2C2Tudi4 v velikih količinah.
Metoda uporablja blato iz procesa Bayerja za zdravljenje boksita (aluminijasti mineral). V procesu Bayerja se boksit zdravi z naoh natrijevim hidroksidom, da se raztopi alumina tega minerala.
V procesu raztapljanja glinice nekatere organske spojine, ki so prisotne v mineralu, kot je huminske kisline, napade NaOH, kar ustvari veliko količino natrijevega oksalata Na2C2Tudi4.
Ta natrijev oksalat je vgrajen v blato z aluminijastimi spojinami. Za čiščenje se sklop raztopi, filtriramo in prenašamo skozi stolpec kislih ionskih izmenjav.
V stolpcu je smola sulfonske kisline RSO3H, kjer se izmenjajo na kovinski ioni+ z vodikovimi ioni h+, Torej dobiš oksalno kislino h2C2Tudi4.
Rso3H + na2C2Tudi4 ⇔ rso3Na + nahc2Tudi4
Vam lahko služi: kalijev karbonat (K2CO3): struktura, lastnosti, uporabe, pridobivanjeRso3H + NAHC2Tudi4 ⇔ rso3Na + h2C2Tudi4
To je gospodarski proces in pridobljena oksalna kislina je sprejemljiva čistost.
Odstraniti neželene spojine
Konjugirana natrijeva oksalatna kislina, oksalna kislina H2C2Tudi4, Uporablja se za raztapljanje nekaterih vrst odpadkov in vložkov.
Oksalna kislina, značilna za postati oksalat, se uporablja kot kompleksno ali oborino, na primer med predelavo odpadkov iz različnih jedrskih goriv.
Oksalna kislina se uporablja tudi za odstranjevanje vložkov mineralov in železovih oksidov v ceveh in drugi opremi, to je posledica njegove sposobnosti, da se močno pridruži vere železov2+ Kot vera železovega iona3+ tvorijo oksalate.
Tveganja
Če natrijev oksalat vdihamo ali ga zaužijemo neposredno. Proizvaja bruhanje, hudo čiščenje, šibek impulz, srčno -žilni propad, nevromuskularne simptome in poškodbe ledvic.
Ljudje, ki imajo nagnjenost k izračunu v ledvicah zaradi kopičenja oksalata v urinu.
Natrijev oksalat v velikih količinah v hrani, ko dosežemo urin, se veže na kalcij, ki je prisoten v tem, in lahko v ledvicah ustvari izračune ali kamne kalcijevega oksalata.
 Natrijev oksalat nekaterih živil lahko privede do nastanka kamnov v ledvicah ljudi s nagnjenostjo k njej. Avtor: Azwer. Vir: Pixabay.
Natrijev oksalat nekaterih živil lahko privede do nastanka kamnov v ledvicah ljudi s nagnjenostjo k njej. Avtor: Azwer. Vir: Pixabay. Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Natrijev oksalat. Nacionalni center za informacije o biotehnologiji. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Chai, w. In Liebman, m. (2005). Vpliv različnih metod kuhanja na vsebnost zelenjavnega oksalata. J. Agric. Food Chem. 2005, 53, 3027-3030. Okrevani iz lokalov.Acs.org.
- Dagani, r. (devetnajst devetdeset šest). CFC Uniči Reion. Arhiv za kemične in inženirske novice 1996, 74, 4, 6-7. Okrevani iz lokalov.Acs.org.
- Sajad, m. in Kim, k.S. (2016). Ekstrakcija zunajceličnih polimernih snovi iz aktiviranega blata z uporabo natrijevega oksalata. Int. J. Okolje. Sci. Technol. 13, 1697-1706 (2016). Povezava je bila obnovljena.Springer.com.
- Jeffrey, g.Do. In parry, g.S. (1954). Kristalna struktura natrijevega oksalata. J. A.M. Kem. Soc. 1954, 76, 21, 5283-5286. Okrevani iz lokalov.Acs.org.
- Okuwaki, a. et al. (1984). Proizvodnja oksalata z oksidacijo premoga s kisikom v koncentrirani raztopini natrijevega hidroksida. Ind. Eng. Kem. Prod. Govedina. Dev. 1984, 23, 648-651. Okrevani iz lokalov.Acs.org.
- Hefter, g. et al. (2018). Topnost natrijevega oksalata v koncentriranih raztopinah elektrolitov. J Chem & Eng podatki. 2018, 63, 3, 542-552. Okrevani iz lokalov.Acs.org.
- La k. Yo. (1992). Postopek za pripravo oksalne kisline in natrijevega vodikovega oksalata iz surovega natrijevega oksalata. Ali.S. Patent št. 5.171.887. Dec.15, 1992. Pridobljeno iz FreePatentssonline.com.
- « Haptes Zgodovina, funkcije, značilnosti, odgovori inmunes
- Natrijev tripolifosfat (NA5P3O10) struktura, lastnosti, uporabe, vpliv »

