Masovna številka, iz česa je sestavljena in kako ga dobiti (s primeri)
- 2267
- 464
- Percy Feeney
On Masna številka o Masna številka atoma je vsota števila protonov in količine jedra nevtronov. Ti delci so označeni za zamenljivo z imenom Nukleoni, Zato množična številka predstavlja količino le -teh.
Naj se število prisotnih nevtronov in z število protonov, če pokličemo, kako masno številko, potem:
A = n + z
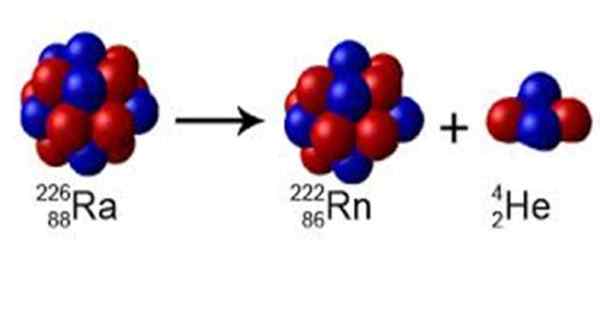
 Slika 1. Radio ima masno številko A = 226, razpade na radon z a = 222 in oddaja jedro helija a = 4. Vir: Wikimedia Commons. Perox [CC0] [TOC]
Slika 1. Radio ima masno številko A = 226, razpade na radon z a = 222 in oddaja jedro helija a = 4. Vir: Wikimedia Commons. Perox [CC0] [TOC]
Primeri masnih številk
Takoj nekaj primerov masnih števil za dobro znane elemente:
Vodik
Najpreprostejši je tudi najbolj stabilen in obilen vodikov atom: 1 proton in elektron. Ker vodikovo jedro nima nevtronov, je res, da je a = z = 1.
Kisik
Jedro kisika ima 8 nevtronov in 8 protonov, torej a = 16.
Ogljik
Življenje na Zemlji temelji na kemiji ogljika, lahkega atoma s 6 protoni v jedru in 6 nevtronov, kot a = 6 + 6 = 12.
Uran
Ta težak element kot prejšnji je dobro znan po svojih radioaktivnih lastnostih. Jedro urana ima 92 protonov in 146 nevtronov. Potem je vaša masna številka A = 92 + 146 = 238.
Kako dobiti množično številko?
Kot že rečeno, masna številka A elementa vedno ustreza vsoti števila protonov in številu nevtronov, ki vsebujejo njegovo jedro. Je tudi celo število, toda ... ali obstaja kakršno koli pravilo v smislu razmerja med obema količinama?
Poglejmo: Vsi zgoraj omenjeni elementi so lahki, razen urana. Atom vodika je, kot smo rekli, najpreprostejši. Nima nevtronov, vsaj v svoji najpogostejši različici, v kisiku in ogljiku pa je enako število protonov in nevtronov.
Lahko vam služi: kaj je brisanje emisij? (S primeri)Zgodi se tudi z drugimi svetlobnimi elementi, kot je dušik, še en zelo pomemben plin za življenje, ki ima 7 protonov in 7 nevtronov. Ker pa je jedro bolj zapleteno in atomi postanejo težji, se število nevtronov povečuje z drugim ritmom.
Za razliko od svetlobnih elementov ima uran z 92 protoni približno 1 ½ krat, ki je v nevtronih: 1 ½ x 92 = 1.5 x 92 = 138.
Kot lahko vidite, je precej blizu 146, količina nevtronov, ki jih ima.
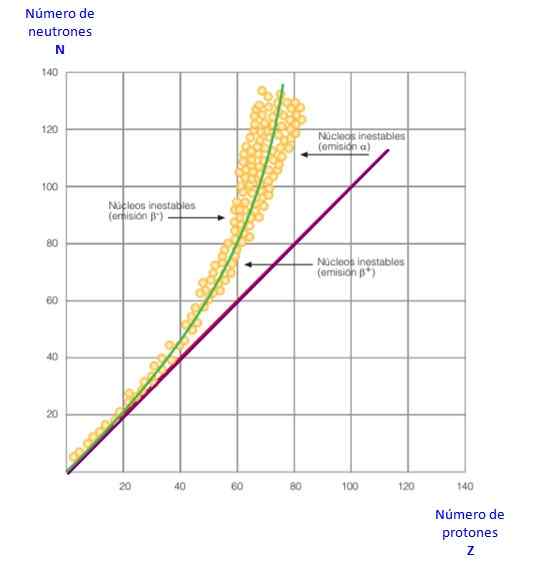 Slika 2. Krivulja stabilnosti. Vir: f. Zapata.
Slika 2. Krivulja stabilnosti. Vir: f. Zapata. Vse to postane razvidno v krivulji slike 2. Je graf N proti Z, znan kot krivulja jedrske stabilnosti. Tam je razvidno, kako imajo lahki atomi enako število protonov kot nevtron in kako se od z = 20 število nevtronov povečuje.
Na ta način velik atom postane bolj stabilen, saj presežni nevtroni zmanjšujejo elektrostatično odbojnost med protoni.
Zapis za atome
Zelo uporaben zapis, ki hitro opisuje vrsto atoma, je naslednji: simbol elementa in ustrezne atomske in masne številke je zapisano, kot je prikazano spodaj v tej shemi:
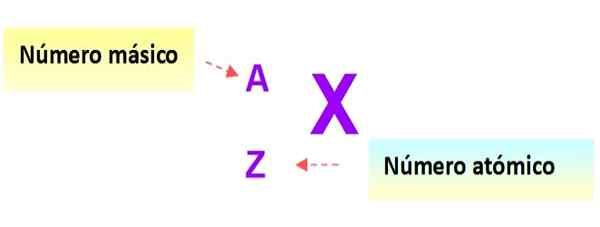 Slika 3. Atom zapis. Vir: f. Zapata.
Slika 3. Atom zapis. Vir: f. Zapata. V tem zapisu bi bili atomi prejšnjih primerov:

Včasih se uporablja še ena bolj udobna zapis, v katerem se uporablja samo simbol elementa in masne številke za označevanje atoma, kar izpusti atomsko številko. Na ta način 12 6C je napisan preprosto kot Carbon-12, 16 8Ali pa bi bil kisik-16 in tako za kateri koli element.
Vam lahko služi: polkrog: Kako izračunati obod, območje, centroid, vajeIzotopi
Število protonov v jedru določa naravo elementa. Na primer, vsak atom, katerega jedro vsebuje 29 protonov, je bakreni atom, karkoli se zgodi.
Recimo, da bakreni atom izgubi elektron iz kakršnega koli razloga, vendar je še vedno baker. Vendar je zdaj ioniziran atom.
Atomsko jedro je težje zmagati ali izgubiti protona, v naravi. Na primer znotraj zvezd so neprekinjeno oblikovani težji elementi iz svetlobnih elementov, saj se zvezdno jedro obnaša kot fuzijski reaktor.
In prav tukaj na zemlji je pojav radioaktivno razpadanje, v katerem nekateri nestabilni atomi izganjajo nukleone in oddajajo energijo, se preoblikujejo v druge elemente.
Končno obstaja možnost, da ima atom določenega elementa drugačno masno številko, v tem primeru je izotop.
Dober primer je znani ogljik-14 oz radiokarbon, ki se uporablja za datum arheoloških predmetov in kot biokemični sledil. To je isti ogljik, z enakimi kemičnimi lastnostmi, vendar z dvema dodatnima nevtronoma.
Carbon-14 je manj obilen kot ogljik-12, stabilen izotop in je tudi radioaktiven. To pomeni, da sčasoma razpade z oddajanjem energije in delcev, dokler ne postane stabilen element, kar je v njegovem primeru dušik.
Ogljikovi izotopi
Ogljik obstaja v naravi kot mešanica več izotopov, od katerih je najpogostejši omenjeni 12 6C ali ogljik-12. In poleg ogljika-14 je tudi 13 6C z dodatnim nevtronom.
Vam lahko služi: izmenična tokostna vezja: vrste, aplikacije, primeriTo je pogosto po naravi, na primer kositra, znanih je 10 stabilnih izotopov. Po drugi strani je en sam izotop znan kot berilij in natrij.
Vsak izotop, naraven ali umeten, ima drugačen ritem transformacije. Na enak način je mogoče ustvariti umetne izotope v laboratoriju, ki so običajno nestabilni in radioaktivno razpadajo v zelo kratkem obdobju drugega ulomka, medtem ko drugi vzamejo veliko več, kolikor je starost Zemlje ali več.
Tabela iz naravnega ogljikovega izotopa
| Ogljikovi izotopi | Atomska številka z | Masna številka a | Obilje % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.enajst |
| 14 6 C | 6 | 14 | Sledi |
Rešeni primeri
- Primer 1
Kaj je razlika med 13 7 N in 14 7 N?
Odgovor
Oba sta atoma dušika, saj je njihovo atomsko število 7. Vendar ima eden od izotopov, ki ima A = 13, manj nevtronov, medtem ko 14 7 N je najpogostejši izotop.
- Primer 2
Koliko nevtronov je v jedru atoma živega srebra, označene kot 201 80 Hg?
Odgovor
Ker a = 201 in z = 80, in tudi vedoč, da:
A = z + n
N = a - z = 201 - 80 = 121
In sklenjeno je, da ima atom živega srebra 121 nevtronov.
Reference
- Connor, n. Kaj je nukleon - struktura atomskega jedra - definicija. Pridobljeno iz: periodično-rabilo.org.
- Vitez, r. 2017. Fizika za znanstvenike in inženiring: strateški pristop. Pearson.
- Sears, Zemansky. 2016. Univerzitetna fizika s sodobno fiziko. 14. Ed. Zvezek 2.
- Tippens, str. 2011. Fizika: pojmi in aplikacije. 7. izdaja. McGraw Hill.
- Wikipedija. Masna številka. Pridobljeno iz: v.Wikipedija.org.
- « Struktura magnezijevega nitrata (mg (NO3) 2), lastnosti, uporabe
- Coplanares točke enačba, primer in rešene vaje »

