Struktura, nitrobenzene (C6H5NO2), lastnosti, uporabe, tveganja

- 4761
- 273
- Adrian Legros
On nitrobenzen To je aromatična organska spojina, ki jo tvori benzenski obroč c6H5- In nitro -ne2. Njegova kemična formula je c6H5Ne2. Je barvita ali bledo rumena mastna tekočina, z vonjem po grenkih mandljih ali čevljih za čevlje.
Nitobenzen je zelo uporabna spojina v kemični industriji, saj omogoča pridobitev vrste kemičnih snovi, ki imajo raznoliko uporabo. To je zato, ker je lahko podvržena različnim vrstam reakcij.
 Nitrobencene, c6H5-Ne2. Avtor: Marilú Stea.
Nitrobencene, c6H5-Ne2. Avtor: Marilú Stea. Med pomembnimi kemičnimi reakcijami je nitracija (kar vam omogoča, da dodate več skupin -ne2 do molekule) in redukcije (nasprotno od oksidacije, ko se dva atoma kisika iz nitro skupine -no odpravita2 in jih nadomestijo vodiki).
Z nitrobencene lahko pripravite na primer anilin in para-acetaminofenol. Slednji je dobro znan acetaminofen, ki je antipiretik (vročina zdravila) in mehki analgetik (manjša bolečina).
Nitobenzen je treba manipulirati previdno, ker je draži in strupen, lahko med več simptomi povzroči vrsto anemije in verjame, da lahko povzroči raka. Škoduje tudi okolju.
[TOC]
Struktura
Nitrobenzen c6H5-Ne2 Gre za ravno molekulo, ki jo tvori benzenski obroč c6H5- na katero je povezana nitro skupina2. Njegova molekula je ravna, ker obstaja elektronska interakcija med nitro -brez skupine2 in benzenski obroč.
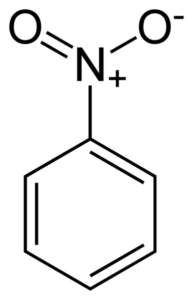 Ravna struktura molekule nitrobenzena. Elektroni dvojnih vezista z obročem ponavadi sodelujejo s skupino Nitro -no2. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
Ravna struktura molekule nitrobenzena. Elektroni dvojnih vezista z obročem ponavadi sodelujejo s skupino Nitro -no2. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Skupina nitro -no2 ponavadi pritegne elektrone benzenskega obroča c6H5-.
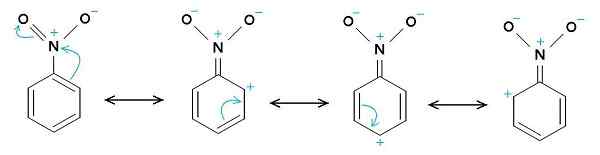 Nitrobenzenske resonančne strukture. Benzenski obroč ima ponavadi pozitivno obremenitev, medtem ko ima skupina Nitro -No2 ponavadi negativno obremenitev. Prvotni nalagalec je bil Samuele Madini na italijanski Wikipediji. [Javna domena]. Vir: Wikimedia Commons.
Nitrobenzenske resonančne strukture. Benzenski obroč ima ponavadi pozitivno obremenitev, medtem ko ima skupina Nitro -No2 ponavadi negativno obremenitev. Prvotni nalagalec je bil Samuele Madini na italijanski Wikipediji. [Javna domena]. Vir: Wikimedia Commons. Zato ima molekula nekoliko bolj negativno stran (kjer je kisik2) in nekoliko bolj pozitivna stran (benzenski obroč).
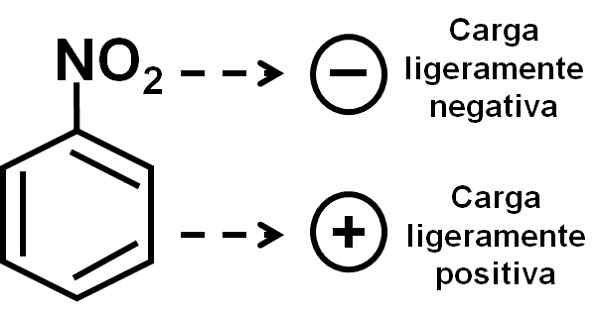 Kisik nitro skupine ima rahlo negativno obremenitev v primerjavi z benzenskim obročem. Avtor: Marilú Stea.
Kisik nitro skupine ima rahlo negativno obremenitev v primerjavi z benzenskim obročem. Avtor: Marilú Stea. Nomenklatura
- Nitrobenzen.
- Nitrobenze.
- Nitrobenzol.
- Olje ali bistvo Mirbana ali Mirbane (zlorabljeni izraz).
Lastnosti
Fizično stanje
Barvita mastna tekočina do bledo rumeno.
Molekularna teža
123,11 g/mol.
Tališče
5,7 ° C.
Vrelišče
211 ° C.
Lahko vam služi: kobalt klorid (COCL2 (: struktura, nomenklatura, lastnostiPlamenišče
88 ° C (metoda zaprte skodelice).
Temperatura samostojnosti
480 ° C.
Gostota
1,2037 g/cm3 pri 20 ° C.
Topnost
Majhna voda topna: 0,19 g/100 g vode pri 20 ° C. Popolnoma mešan z alkoholom, benzenom in dietičnim etrom.
Kemične lastnosti
Nitrobencene je stabilen do približno 450 ° C temperature, v kateri se začne razpadati (v odsotnosti kisika) ne, ne2, benzen, bifenil, anilin, dibenzofurano in naftalena.
Med pomembnimi reakcijami nitrobencena so zmanjšanje, nitracija, halogenacija in sulfonacija.
Nitrobenzenska nitracija sprva proizvaja meta-nitrobenzen in z dolgim časom reakcije dobimo 1,3,5-nitobenzen.
Reagiranje broma ali klora z nitrobenzenom v prisotnosti ustreznega katalizatorja dobimo 3-bromo-nitrobenzen (meta-bromonitrobencen) ali 3-clor-nitrobenzen (meta-kloronitrobenzen).
Primer zmanjšanja je, da meta-halogenoanilini pri obravnavi kositra (sn) v klorovodiki (HCl) dobimo meta-halogenonitobenzene.
Sulfonacija nitrobenzena se izvaja s kajenjem žveplove kisline pri 70-80 ° C, produkt. To lahko zmanjšate z železom in HCl, da daste metanilno kislino.
Nastanek zatemnitve
V raztopini benzena c6H6 Molekule nitrobencena so povezane med seboj, ki tvorijo premer ali pari molekul. V teh parih je ena od molekul v obrnjenem položaju glede na drugo.
Nastajanje premerov nitrobenzena z molekulami, ki so v obrnjenem položaju glede na drugega.
V dimeru je stran z nekoliko bolj pozitivnim bremenom ene od molekul morda nameščena blizu rahlo negativne obremenitve druge molekule, ker se privlačijo nasprotne obremenitve, zato se zgodi z drugimi dvema stranema.
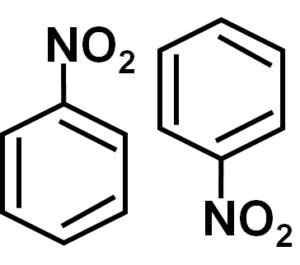 Število nitrobencena, torej dve molekuli, ki sta ponavadi skupaj v nekaterih topilih. Avtor: Marilú Stea.
Število nitrobencena, torej dve molekuli, ki sta ponavadi skupaj v nekaterih topilih. Avtor: Marilú Stea. Druge lastnosti
Predstavlja vonj, podoben mandlji ali lak za čevlje. Z znižanjem njene trditve temperature v obliki zelenkasto rumenih kristalov.
Pridobivanje
Zdravljenje benzena c6H6 Z mešanico dušikove kisline hno3 in žveplova kislina h2SW4. Postopek se imenuje nitracija in vključuje oblikovanje nitronija iona2+ Zahvaljujoč prisotnosti žveplove kisline h2SW4.
- Nitronio ion št2+:
Hno3 + 2 h2SW4 ⇔ h3Tudi+ + 2 HSO4- + Ne2+ (Nitronio ion)
- Nitronio ion napade benzene:
Vam lahko služi: sistematična napaka: Kako jo izračunati v kemiji, v fiziki, primeriC6H6 + Ne2+ → c6H6Ne2+
- NITROBENCENE je oblikovan:
C6H6Ne2+ + HSo4- → c6H5Ne2 + H2SW4
V povzetku:
C6H6 + Hno3 → c6H5Ne2 + H2Tudi
Reakcija nitracije benzena je zelo eksotermična, to je zelo toplota, zato je zelo nevarna.
Prijave
Pri pridobivanju anilina in acetaminofena
Nitrobencene se uporablja predvsem za sintezo anilina c6H5Nh2, ki je široko uporabljena spojina za pripravo pesticidov, dlesni, barvil, eksplozivov in zdravil.
Pridobivanje anilina se pojavi z zmanjšanjem nitrobenzena v kislem mediju v prisotnosti železa ali kositra, ki se izvaja v skladu z naslednjimi koraki:
Nitrobenzen → nitrozobenzen → fenilhidroksilamin → anilin
C6H5Ne2 → c6H5Ne → c6H5NHOH → C6H5Nh2
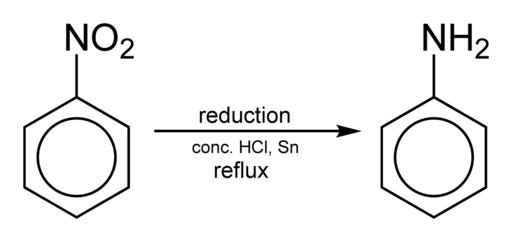 Zmanjšanje nitrobencena za pridobitev anilina. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Zmanjšanje nitrobencena za pridobitev anilina. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Odvisno od pogojev je mogoče postopek ustaviti v enem od vmesnih korakov na primer v fenilhidroksilaminu. Začenši od fenilhidroksilamina v močno kislem okolju, lahko pripravimo para-aminofenol:
Fenilhdroksilamin → str-Aminofenol
C6H5NHOH → HOC6H4Nh2
Slednji se zdravi z ocetnim anhidridom, da dobimo paracetamol (acetaminofen) nežno antipiretik in mehki analgetik, to je zdravilo za zdravljenje vročine in bolečine ter bolečine.
 Včasih je mogoče z acetaminofenom z otroki z vročino. Acetaminofen je derivat nitrobenzena. Avtor: Augusto Ordonez. Vir: Pixabay.
Včasih je mogoče z acetaminofenom z otroki z vročino. Acetaminofen je derivat nitrobenzena. Avtor: Augusto Ordonez. Vir: Pixabay.  Tablete acetaminofen, derivat nitrobenzena. Paracetamol_acetaminophen_500_mg_pils.JPG: Pleme Michelle iz Ottawe, Canadaderivative Work: Anrie [CC by (https: // createCommons.Org/licence/by/3.0)]. Vir: Wikimedia Commons.
Tablete acetaminofen, derivat nitrobenzena. Paracetamol_acetaminophen_500_mg_pils.JPG: Pleme Michelle iz Ottawe, Canadaderivative Work: Anrie [CC by (https: // createCommons.Org/licence/by/3.0)]. Vir: Wikimedia Commons. Drug način za pridobitev anilina je z zmanjšanjem nitrobenzena z ogljikovim monoksidom (CO) v vodnem mediju v prisotnosti zelo majhnih delcev (nanodelcev) paladija (PD) kot katalizatorja.
C6H5-Ne2 + 3 co + h2O → c6H5-Nh2 + 3 co2
Pri pridobivanju drugih kemičnih spojin
Nitobenzen je izhodišče za pridobitev najrazličnejših uporabljenih spojin, kot so barvila, pesticidi, zdravila in kozmetika.
 Nekatera barvila dobimo zahvaljujoč nitrobenzenu. Avtorica: Edith Lüthi. Vir: Pixabay.
Nekatera barvila dobimo zahvaljujoč nitrobenzenu. Avtorica: Edith Lüthi. Vir: Pixabay. Na primer, omogoča pridobitev 1,3-dinitrobencena, da s kloriranjem (dodajanjem klora) in redukcijo (izločanje kisikovih atomov) ustvari 3-kloroanilin. To se uporablja kot posrednik za pesticide, barvila in zdravila.
Nitobenzen je bil uporabljen za pripravo benhidina, ki je barvilo. Poleg tega nitrobenzen služi za pripravo kinolina, azobenzena, metanil kisline, diitobenzena, izociata ali piroksilina med številnimi drugimi spojinami.
V več aplikacijah
Nitobenzen se uporablja ali uporablja kot:
Vam lahko služi: nenasičeni ogljikovodiki- Ekstrakcijsko topilo za čiščenje mazalnih olj, ki se uporabljajo v strojih
- Topilo za celulozne etre
- Mešana sestavina za poljske kovine
- V milih
- V mešanicah za poljske čevlje
- Konservator za brizgalno barvo
- Talna komponenta mešanice
- Nadomestek mandljevega bistva
- V parfumski industriji
- V proizvodnji sintetične gume
- Topilo v različnih procesih
 Nitobenzen je del nekaterih mešanic za poljske čevlje. D-kuru [cc by-sa 3.0 at (https: // createCommons.Org/licence/by-sa/3.0/at/Deed.v)]. Vir: Wikimedia Commons.
Nitobenzen je del nekaterih mešanic za poljske čevlje. D-kuru [cc by-sa 3.0 at (https: // createCommons.Org/licence/by-sa/3.0/at/Deed.v)]. Vir: Wikimedia Commons. Tveganja
Nitobenzen je strupen z vdihavanjem, zaužitjem in absorpcijo skozi kožo.
Draži kožo, oči in dihalne trakte. Lahko povzroči vrsto anemije, imenovane methemoglobinemia, ki je sestavljena iz zmanjšanja sposobnosti rdečih krvnih celic, da sprostijo kisik v tkivih in ustvarjajo utrujenost.
Poleg tega Nitrobencene povzroča dispnejo, omotico, razburjeno vizijo, pomanjkanje diha, propadanje in smrt. Prav tako poškoduje jetra, vranico, ledvice in centralni živčni sistem.
Ocenjuje se, da je lahko mutagen in morda povzroča človeški rak, saj ga je povzročil pri živalih.
Poleg tega nitrobencene v okolju ne smete zavreči. Njegova toksičnost do živali, rastlin in mikroorganizmov je zelo škodljiva za ekosisteme.
Toksičnost do mikroorganizmov zmanjšuje njegovo biološko razgradljivost.
Zdravljenja za odpravo okolja
Onesnaževanje okolja z Nitrobencene se lahko pojavi zaradi odpadkov različnih panog, ki ga uporabljajo, na primer barvna industrija ali eksploziva.
Nitobenzen je zelo strupen in ga je težko razčleniti v naravnih pogojih, zato lahko povzroči hudo kontaminacijo v pištoli in sejalne namakalne sisteme.
Zaradi visoke stabilnosti in toksičnosti do mikroorganizmov je pogosto izbran kot model v študijah čiščenja odplak.
Raziskujejo različne načine za odpravo onesnaženega vodnega nitrobenzena. Eden od njih je s fotokatalitično razgradnjo, to je uporaba sončne svetlobe kot pospeševalnika reakcije razgradnje v prisotnosti titanovega dioksida titana2.
 Z reaktorjem sončne svetlobe je mogoče odpraviti onesnaževanje vode z nitrobencene. Mihai-Cosmin Pascariu [CC by-SA (https: // createCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Z reaktorjem sončne svetlobe je mogoče odpraviti onesnaževanje vode z nitrobencene. Mihai-Cosmin Pascariu [CC by-SA (https: // createCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Metode mikroelektrolize so bile tudi uspešno preizkušene z železnim katalizatorjem (vera) in bakrom (Cu) v keramiki. Mikroelektroliza omogoča, da se nitrobenzen razgradi skozi električni tok.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Nitrobenzen. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Morrison, r.T. in Boyd, r.N. (2002). Organska kemija. 6. izdaja. Prentice-Hall.
- Moldovianu, s.C. (2019). Piroliza drugih spojin z dušikovimi cenami. V pirolizi organskih molekul (druga izdaja). Okrevano od Scientirect.com.
- Smith, str.W.G. et al. (1969). Aromatične nitracije-nitro spojine. Elektrofilne substitucije. V aromatični kemiji. Okrevano od Scientirect.com.
- Windholz, m. et al. (uredniki) (1983). Indeks Merck. Enklopedija kemikalij, zdravil in bioloških. Deseta izdaja. Merck & co., Inc.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek A22. VCH Verlagsgellschaft MBH.
- Whang, t.-J. et al. (2012). UV-iradirana fotokatalitična razgradnja nitrobenzena s Titanijo vezavo na kremenčevo cev. International Journal of Photoenergy, zvezek 2012, članki ID 681941. Hyndawi si je opomogel.com.
- Shikata, t. et al. (2014). Tvorba nitrobenzena proti vzporedni dimeru v nepolarnih topilih. AIP Advances 4, 067130 (2014). Okreval od Doaja.org.
- Krogul-Obczak, a. et al. (2019). Zmanjšanje nitrobenzena na anilin s Co/H2Ali v priči paladijevih nanodelcev. Catalysts 2019, 9, 404. MDPI se je okreval.com.
- Yang, b. et al. (2019). Proizvodnja pilotske lestvice, lastnosti in uporaba Fe/Cu katalitično-keramičnega polnjenja za nitrobenzenske spojine čiščenja odpadne vode. Catalysts 2019, 9, 11. MDPI se je okreval.com.
- « Formula mehanske prednosti, enačbe, izračun in primeri
- 110 večnih ljubezenskih stavkov za fante in može »

