Lastnosti nitritov, struktura, nomenklatura, usposabljanje
- 5047
- 341
- Dexter Koch
The nitriti So vse tiste spojine, ki ne vsebujejo aniona2-, Če so anorganski ali skupina -Ono, če so organski. Velika večina je kovinskih nitritov, ki so anorganske soli, kjer ne2- Elektrostatično interakcijo s C kationomn+; Na primer natrijev kation, NA+.
Tako natrijev nitrit, nano2, Je primer soli ali nitritne spojine. Te soli najdemo v naravi, bodisi v tleh, morjih, sesalcih in rastlinskih tkivih, saj so del biološkega cikla dušika. Zato ne2- To je snov, ki je prisotna v naših organizmih in je povezana z vazodilatacijskimi procesi.
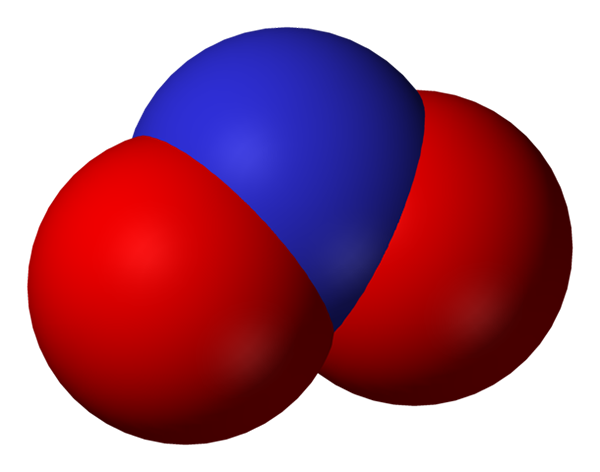
 Prostor, poln nitrit aniona. Vir: Benjah-BMM27.
Prostor, poln nitrit aniona. Vir: Benjah-BMM27. Nitrit postane manjša oblika dušika ali manj oksidira3-. Iz njega se pojavi dušikov oksid, ne v regijah organizma, kjer je pomanjkanje kisika. Ni signalna molekula, ki ima vazodilatacijski učinek s sproščanjem mišic in arterij.
Iz biokemije in medicine se kot baktericidi uporabljajo nitriti, saj so njihova združevanje do precej običajnega mesa. To z namenom, da jih pozdravi in dlje razširi kakovost in svežino.
Nitrit ima dva obraza: eden, ki je koristna za zdravje, in drugi, ki ga ogroža. Dober obraz je ravno posledica reakcij, ki ga zmanjšajo na ne. Medtem je slab obraz posledica preobrazbe z nitrozaminom: družino organskih spojin, ki imajo več članov, ki so bili prepoznani kot rakotvorne snovi.
[TOC]
Lastnosti nitritov
Basicy
Nitriti so osnovne soli, ker anion ne2- To je konjugirana baza dušikove kisline, hno2:
Hno2 + H2Ali ⇌ ne2- + H3Tudi+
V vodi in v nekaj količinah je hidrolizirano, da izvira OH ione-:
Ne2- + H2Ali ⇌ hno2 + Oh-
Ta bazičnost je bistvena za vse nitritne soli, saj je odvisna od ne2- in ne kationov, ki ga spremljajo. Vendar so te katione in njihove interakcije z NO2- Vplivajo na topnost nitritnih soli v vodi in drugih polarnih topilih.
Reakcije
Reakcije nitritov se razlikujejo glede na to, katere kationi spremljajo št2-, ali gre za organski nitrit, Rono. Na splošno se lahko nitriji razgradijo, oksidirajo ali zmanjšajo na: kovinske okside, ne3-, Ne2, Ne in celo dušikovni plin, n2.
Vam lahko služi: termodinamični procesiNa primer, amonijev nitrit, NH4Ne2 se lahko razgradi na n2 in h2Tudi.
Fizični nastopi
Skoraj vsi nitriti so trdne snovi kristalnega videza. Mnogi so belkaste ali rumenkaste barve, čeprav obstajajo barvite, če vsebujejo katione prehodnih kovin.
Po drugi strani pa so večinoma organski nitriti zelo nestabilni in eksplozivni hlapni tekočine.
Struktura
Nitrit anion
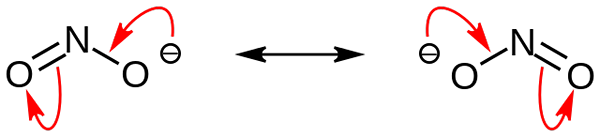 Nitritne anionske resonančne strukture. Vir: Nohingserius / Pub Domain
Nitritne anionske resonančne strukture. Vir: Nohingserius / Pub Domain Na prvi sliki je bil nitritni anion prikazan s celotnim prostorom. Ta model ima pomanjkljivost, ki je popolnoma enaka kot pri dušikovem dioksidu, ne2. Po drugi strani pa nadrejena slika bolje opisuje nitritni anion in kako se obnaša njena negativna obremenitev.
Ta obremenitev je premeščena med dvema atoma kisika, tako da ima vsak polovico omenjene negativne obremenitve (-1/2). In to negativno breme, ki je odgovorno za privabljanje okoliških kationov zaradi preproste elektrostatične privlačnosti.
Trdne snovi
Anorganski nitriti so vse kristalne trdne spojine. Njegove interakcije so izključno elektrostatične, privlačnost med NO2- in kationi mn+. Tako na primer nano2 Ima ortorrombično kristalno strukturo, tvorijo pa jo Ioni+ in ne2-.
Vrsta kristalne strukture bo odvisna od identitete m+n, Torej vsi nitriti delijo ortorrombično strukturo.
Organski nitriji
Organski nitriti, za razliko od anorganskih, niso ionske spojine, ampak kovalentne. Zato so oblikovane iz molekul, za katere je značilna povezava R-AON, kjer je R lahko alkilna ali aromatična skupina.
Šteje se za dušikove kislinske estre, saj njihov vodik, H-DON, nadomešča skupina R:
 Splošna formula za organski nitrit. Vir: pngbot prek Wikipedije.
Splošna formula za organski nitrit. Vir: pngbot prek Wikipedije. Po vrhunski sliki bi ta ester lahko zapisali kot rum = o, zelo podobni formuli ogljikovih estrov, ROC = O. Upoštevajte veliko podobnost, ki jo ima ta struktura z nitro spojinami, RNO2, kjer je zdaj glavna povezava R-ne2 in ne r-dono. Edina razlika je torej v atomu, s katerim se pridruži2 v skupino r.
Zaradi tega se nitritni estri in nitro spojine štejejo za izomere povezav, saj imajo enake atome, vendar so drugače povezane.
Kompleksen
Nitritni kompleksi imajo lahko anorganske in organske komponente. Tvori koordinacijsko povezavo med kovinskim centrom in enim od kisika brez kisika2-. Se pravi, da o čisto elektrostatični interakciji ni govora, mn+Ne2-, Toda usklajevanja mn+-Ali ne-.
Vam lahko služi: kakšne so fizične lastnosti snovi?Organski nitriti in njihovi kompleksi bodo vzpostavili ali ne kristalne strukture, odvisno od tega, ali njihove interakcije uspejo postaviti svoje delce v vesolje.
Nomenklatura
Anorganski in organski nitriji imajo precej preprosto nomenklaturo. Če jih poimenujemo, so besede "nitrit of", ki mu sledi ime kovine in njena valenca, napisana v oklepajih. Prav tako končnice -co in -o v primeru, da je mogoče uporabiti več kot ena Valencija.
Na primer cuno2 lahko poimenujemo na dva načina: bakreni nitrit (i) ali cuprous nitrit.
To pravilo nomenklature velja tudi za organske nitrije. Na primer CHO3Ono se imenuje Metilo nitrito, ker ch3 ustreza skupini R, povezano z nesiknim kisikom2.
Nomenklatura se lahko zaplete, če obstajajo druge skupine enake ali večje kemične pomembnosti kot NO2, ali če so kovinski kompleksi.
Usposabljanje
Nitrifikacija
V enem od korakov dušikovega cikla: nitrifikacija se v naravi oblikujejo številni anorganski nitriji: nitrifikacija. Ta proces je sestavljen iz oksidacije amoniaka, ki ga izvajajo mikroorganizmi, zlasti z nitrosomanskimi bakterijami.
Nitrifikacija zajema tudi naknadno oksidacijo nitrata do nitrata; Vendar je tvorba nitrita počasen korak teh reakcij, saj zahteva večjo energijo in mora premagati večjo kinetično pregrado.
Naslednja enačba prikazuje novo izpostavljene:
2NH4+ + 3. mesto2 → 2no2- + 4H+ + 2H2Tudi
V tej reakciji sodeluje več encimov in nastaja hidroksilamin, NH2Oh, ki je izdelek, iz katerega bodo končno izvirali nitritni anioni.
Zahvaljujoč nitrifikaciji rastline vsebujejo nitrite, in po drugi strani živali, ki jih uživajo. Nitriti niso prisotni samo v tleh, ampak tudi v morjih, skoraj vsa njihova naravna proizvodnja pa je posledica oksidativnega in anaerobnega delovanja različnih mikroorganizmov.
Dušikovi oksidi v osnovnih medijih
Nitrite alkalnih kovin lahko pripravimo industrijsko z mehurčki dušikovih oksidov v osnovnih raztopinah ali medijih, bodisi iz njihovih hidroksidov ali karbonatov. Na primer, natrijev nitrit se pojavi v skladu z naslednjo reakcijo:
Ne +ne2 + Naoh → 2nano2 + H2Tudi
V primeru amonijevega nitrita je v amonijaku zasut diitrogen trioksid:
Vam lahko služi: rodio: zgodovina, lastnosti, struktura, uporabe, tveganje2NH3 + H2Ali +n2Tudi3 → 2nh4Ne2
Reakcija z dušikovim oksidom
Alquilico nitrites, rono, lahko sintetiziramo z reactom. Splošna reakcija bi bila naslednja:
R-OH → R-AON
Aplikacija nitritov
Ozdravitev mesa
 Rdečkasta barva mesa je posledica zdravljenja z nitratnimi soli in nitratom. Vir: pxhere.
Rdečkasta barva mesa je posledica zdravljenja z nitratnimi soli in nitratom. Vir: pxhere. Nitriti imajo antibakterijske učinke, zato jih v zmernih količinah dodajo mesu, da upočasnijo njihovo gnilobo. Poleg tega, da izpolnjujejo to funkcijo, reagirajo z mesnimi beljakovinami, da jim podelijo bolj rdečkasto in privlačno obarvanost.
Slaba plat te prakse je, da imajo nekatere meso lahko preveč nitritnih soli, in ko jih kuhajo pri visokih temperaturah, se spremenijo v nitrozoamine. Zato obstaja tveganje za povečanje možnosti, da bi se zboleli za nekakšno vrsto raka.
Rod barvila
Nitriti se v organski kemiji uporabljajo za izvedbo diazotacijske reakcije, s katero se sintetizirajo barvanje ali barvila.
Pigmenti
Nekateri nitritni kompleksi, kot je kobalt, se lahko uporabljajo kot pigmenti za slike ali porcelan zaradi njihovih presenetljivih obarvanj.
Vazodilatator
Nitriti so odgovorni za ustvarjanje dušikovega oksida v telesu v pomanjkljivih kisikovih regijah. Ni signalna molekula, ki se odziva na krvne žile, ki se sproščajo in širijo. Ta širitev ali dilatacija ima posledično, da se krvni tlak zniža.
Primeri nitritov
Nazadnje bo nekaj primerov nitritov navedeno s svojimi formulami in imeni:
-Starejši brat2: natrijev nitrit
-Kno2: kalijev nitrit
-Mg (št2)2: Magnezijev nitrit
-Izliv2)2: kalcijev nitrit
-Pogl3Pogl2Ono: etil nitrit
-Nh4Ne2: amonijev nitrit
-Zn (št2)2: cink nitrit
-PB (št2)2: Svinčev nitrit (ii) ali vodni nitrit
-Vera (ne2)3: Železov nitrit (iii) ali železni nitrit
-(Pogl3)2Chch2Pogl2Ono: Isoamilo nitrito
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). Nitrit. Pridobljeno iz: v.Wikipedija.org
- Elsevier b.V. (2020). Nitrit. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Alfa Aesar. (2020). Nitritne soli. Temo Fisher Scientific. Okreval od: alfa.com
- Uredniki Enyclopeedia Britannica. (23. februar 2018). Nitriti. Encyclopædia Britannica. Okrevano od: Britannica.com
- Anthony R. Butler & Martin Feelisch. (22. april 2018). Terapevtska uporaba anorganskega nitrita in nitrata. doi.org/10.1161/CirculationHa.107.753814
- Kris Gunnars. (10. februar 2020). So nitrati in nitriji v hrani škodljivi? Okrevano od: Healthline.com
- « Teorija družbenega vedenja, vrste, norme, primeri
- Oblikovanje binarnih spojin, tipi, primeri, nomenklatura »

