Oblikovanje binarnih spojin, tipi, primeri, nomenklatura
- 5094
- 743
- Miguel Gutmann DVM
The binarne spojine Vsi tvorita dva kemična elementa, ne glede na število njihovih atomov ali njihove interakcije. Splošna formula za te spojine jenBm, kjer sta A in B dva različna elementa periodične tabele in n in m njihovi stehiometrični koeficienti.
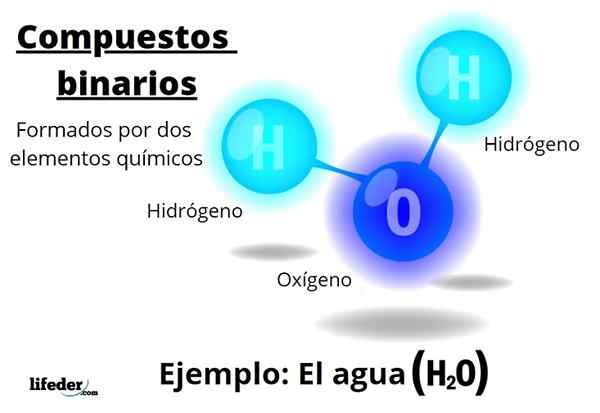
Na primer voda, h2Ali pa je binarna spojina, ki je morda najbolj reprezentativna. Voda je sestavljena iz vodika, H in kisika ali s tem dodajata dva kemična elementa. Upoštevajte, da njegovi stehiometrični koeficienti kažejo, da obstajata dva vodika in en kisik, vendar je še vedno binarna spojina.

Binarne spojine so lahko sestavljene iz ionov, molekul, tridimenzionalnih omrežij ali celo nevtralnih kovinskih atomov. Pomembno je, da ne glede na naravo njene kemične vezi ali njene sestave vedno tvorita dva različna kemična elementa. Na primer vodikov plin, h2, ne šteje za binarno spojino.
Binarne spojine se sprva ne zdijo tako obilne in zapletene v primerjavi s trinarnimi ali kvartarnimi spojinami. Vendar pa je med njimi veliko bistvenih snovi za kopenske ekosisteme, kot so soli, oksidi, sulfidi in nekateri plini neizmerne biološke in industrijske vrednosti.
[TOC]
Kako so binarne spojine?
Metode priprave ali sintetične poti za oblikovanje binarnih spojin bodo odvisne od identitete dveh kemičnih elementov A in B. Vendar morata biti načeloma in na splošno oba elementa kombinirana v reaktorju, da lahko medsebojno komunicirata. Če so pogoji ugodni, bo potekala kemična reakcija.
S kemično reakcijo se bosta elementa A in B pridružila ali povezala (ionsko ali kovalentno), da tvorita spojino donBm. Številne binarne spojine se lahko oblikujejo z neposredno kombinacijo njihovih dveh čistih elementov ali po drugih bolj ekonomsko izvedljivih alternativnih metodah.
Lahko vam služi: cinkov oksid (ZnO): struktura, lastnosti, uporabe, tveganjaVrnitev na primer vode, vodik, h2, in kisik, ali2, Združujejo se pri visokih temperaturah, tako da med njimi obstaja reakcija zgorevanja:
2H2(g) + oz2(g) → 2H2O (g)
Na drugi strani lahko vodo dobimo z dehidracijskimi reakcijami spojin, kot so alkoholi in sladkorji.
Drug primer tvorbe binarne spojine ustreza železovemu sulfidu, FES:
Vere (s) + s (s) → FES (S)
Kjer sta ta čas, sta železo in žveplo trdna in ne soda snovi. In to je enako z več binarnimi soli, na primer natrijevega klorida, NaCl, ki združuje kovinski natrij s klorovimi plini:
2na (s) + cl2(g) → 2nacl (s)
Nomenklatura
Imena vseh binarnih spojin večinoma urejajo enaka pravila.
Za spojinonBm, Ime B je najprej omenjeno v svoji anionski obliki; to je s koncem -Uro. Vendar pa je v primeru, da je B sestavljen iz kisika, imenovan kot oksid, peroksid ali superoksid.
Pred imenom B so grški številčni predponi (Mono, DI, Tri, Tetra itd.) glede na vrednost m.
Končno je omenjeno ime elementa A. V primeru, da ima več kot eno valenco, je označena z rimskimi številkami in v oklepajih. Ali če je prednostno, lahko izberete tradicionalno nomenklaturo in uporabite pripone -Ooso e -ico. Element A včasih tudi grške številčne predpone v skladu z vrednostjo n.
Razmislite o naslednjih binarnih spojinah skupaj z njihovimi imeni:
-H2O: vodikov oksid ali dihidrogenov monoksid (ta priimek je vzrok za draženje)
-FES: železov sulfid (II) ali železov sulfid
-NaCl: natrijev klorid ali natrijev klorid
Vam lahko služi: oljni ali benzinski eter: formula, struktura, uporaba-MGCL2: magnezijev klorid, magnetni klorid ali magnezijev diklorid
Upoštevajte, da ni rečeno "Monosodijev klorid" ali "Monohierro sulfid".
Vrste: razvrstitev binarnih spojin
Binarne spojine so razvrščene glede na to, kaj se tvorijo ali dejstva: ioni, molekule, kovinski atomi ali omrežja. Kljub temu ta klasifikacija ni povsem prepričljiva ali dokončna, saj se lahko razlikuje glede na obravnavani pristop.
Ionska
V ionskih binarnih spojinah A in B sestojita iz ionov. Tako za spojinonBm, B je ponavadi anion, b-, Medtem ko kation, do+. NaCl na primer spada v to klasifikacijo, pa tudi v vse binarne soli, katerih splošne formule so bolje predstavljene kot MX, kjer je x anion, in m kovinski kation.
Tako fluoridi, kloridi, bromuros, jodid., Pripadajo tudi tej klasifikaciji. Vendar je treba opozoriti, da so nekateri kovalentni, zato pripadajo naslednji klasifikaciji.
Kovalentna
Kovalentne binarne spojine tvorijo molekule. Voda pripada tej klasifikaciji, saj je sestavljena iz molekul H-O-H. Vodikov klorid, HCl, velja tudi za kovalentno binarno spojino, saj ga sestavljajo molekule H-CL. Upoštevajte, da je NaCl ionski, medtem ko je HCl kovalenten, oba klorida pa sta.
Kovinsko ali omrežje
Binarne spojine pokrivajo tudi zlitine in trdne snovi treh dimenzijskih omrežij. Vendar pa se za njih običajno uporablja poimenovanja binarnih materialov.
Na primer, medenina, več kot spojina, velja za binarni material ali zlitino, saj ga tvorita baker in cink, Cu-Zn. Upoštevajte, da ni napisano tako, da ni opredelil stehiometričnih koeficientov.
Prav tako obstaja silicijev dioksid, sio2, tvorita silicij in kisik. Njihovi atomi so povezani z definiranjem tridimenzionalnega omrežja, kjer ne morete govoriti o molekulah ali ionih. Številni nitridi, fosfon in karbidi, kadar niso ionski, govorijo tudi o tej vrsti omrežij.
Vam lahko služi: fenoksiocetna kislina: sinteza, postopek, uporabe, tveganjaPrimeri binarnih spojin
 Voda je primer binarne spojine
Voda je primer binarne spojine Navedena bo za zaključek več binarnih spojin, ki jih spremljajo njihova imena:
-LEBR: Litijev bromid
-Cacl2: Kalcijev klorid
-FECL3: železov klorid (iii) ali železov klorid
-NAO: natrijev oksid
-Beh2: berilijev hidrid
-Co2: ogljikov dioksid
-Nh3: Dušik ali amonijak trihidrid
-BDP2: Svinčeno jodid (ii) ali svinčeno diyoduro
-Mg3N2: Magnezijev nitruro
-Do2Tudi3: Aluminijev oksid ali diauminijev trioksid
-Na3V: natrijev fosfuro
-Alf3: Aluminijev fluorid
-Racl2: radijski klorid ali radijski diklorid
-Bf3: Boro Trifluoruro
-RBI: Rubidio Yoduro
-WC: Tungsten Carbide ali Wolframium
Vsak od teh primerov ima lahko več kot eno ime naenkrat. Od teh, co2 Veliko vpliva na naravo, saj ga rastline uporabljajo v procesu fotosinteze.
Po drugi strani pa NH3 Je ena od snovi z najbolj industrijsko vrednostjo, potrebna za sintezo polimerne in organske sinteze. In končno je WC eden najtežjih materialov, kar jih je kdajkoli ustvaril.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Artem Cheprasov. (2020). Kaj je binarna spojina? - Definicija in primer. Študij. Okrevano od: študij.com
- Čelada, Anne Marie, ph.D. (11. februar 2020). Opredelitev binarne spojine. Okreval od: Thoughtco.com
- ByJU's. (2020). Kaj so binarne spojine? Okreval od: byjus.com
- Chemteam. (s.F.). Binarne spojine kovin s fiksnimi naboji. Okrevano od: chemteam.Informacije
- Wikipedija. (2020). Binarna faza. Pridobljeno iz: v.Wikipedija.org
- « Lastnosti nitritov, struktura, nomenklatura, usposabljanje
- Reakcijska flokulacija, vrste, aplikacije, primeri »

