Nitrilne lastnosti, nomenklatura, uporabe, primeri

- 2772
- 791
- Ignacio Barrows
The Nitrile So vse tiste organske spojine, ki imajo funkcionalno skupino CN, ki se imenuje tudi kot cianoška skupina, ali cianid v smislu anorganske kemije. Alifatski nitrili so predstavljeni s splošno formulo RCN, aromatični nitrili s formulo Arcn.
Čeprav so vodikov cianid, HCN in tudi cianidne kovinske soli zelo strupene spojine, se popolnoma enaka ne zgodi z nitrili. Skupina CN v ogljikovem okostju katere koli vrste (razvejana, linearna, aromatična itd.), se obnaša diagonalno drugačno od cianidnega aniona, CN-.
 Splošna formula za alifatski nitril. Vir: Benjah-BMM27 prek Wikipedije.
Splošna formula za alifatski nitril. Vir: Benjah-BMM27 prek Wikipedije. Nitrile so v svetu plastike zelo razširjene, saj jih več izhaja iz acrilonitrila, ch2CHCN, nitril, s katerim se sintetizirajo polimeri, kot so nitrilne gume, ki se uporabljajo za izdelavo operacij ali laboratorijskih rokavic. Nitrile so prisotne tudi v številnih naravnih in farmacevtskih izdelkih.
Po drugi strani so nitrili predhodniki karboksilnih kislin, saj njihova hidroliza predstavlja alternativno metodo sinteze za pridobitev slednje.
[TOC]
Značilnosti in lastnosti
Struktura
Molekularne strukture nitrilov se razlikujejo glede na identiteto R ali AR v spojinah RCN oziroma ARCN.
Vendar je geometrija skupine CN linearna zaradi svoje trojne povezave, C≡N, ki je produkt hibridizacije SP. Tako so atomi C-C≡N nameščeni v isti črti. Poleg teh atomov lahko obstaja kakršna koli struktura.
Polarnost
Nitrile so polarne spojine, saj je dušik skupine CN zelo elektronegativen in pritegne elektrone k sebi. Zato imajo fuzijske ali vrelišča višje od svojih homologov.
Lahko vam služi: Scandio: Zgodovina, lastnosti, reakcije, tveganja in uporabeNa primer acetonitrile, cho3CN, to je tekočina, ki zavre pri 82 ° C; Medtem ko Etano, ch3Pogl3, Je plin, ki zavre pri -89 ° C. Upoštevajte velik učinek, ki ga ima skupina CN na medmolekularne interakcije.
Enako sklepanje velja za večje spojine: Če imajo v svoji strukturi eno ali več skupin CN, je povsem verjetno, da se bo njihova polarnost povečala in bolj povezana s površinami ali polarnimi tekočinami.
Basicy
Lahko bi mislili, da so zaradi visoke polarnosti nitrilov to razmeroma močne podlage pred amini. Vendar moramo upoštevati kovalentne vezi C≡N in dejstvo, da imata tako ogljik kot vodik hibridizacijo SP.
Osnovna RCN: predstavljena je s sprejemanjem protona iz vode: voda:
RCN: + H2Ali ⇌ rcnh+ + Oh-
Za protoniranje RCN: Navor brez elektrona na dušiku mora tvoriti povezavo z ionom H+. Vendar obstaja neprijetnost: hibridizacija dušika je preveč elektronegativna, toliko, da se ta par elektronov zelo močno privlači in sploh ne dovoli, da se tvori vez.
Zato se reče, da dušikov SPER par dušika ni na voljo in da je osnovna nitrija zelo nizka. Pravzaprav so nitrili milijoni krat manj osnovni kot amini.
Reaktivnost
Med najbolj reprezentativnimi reakcijami nitrilov imamo njihovo hidrolizo in zmanjšanje. Te hidrolize posredujejo kislost ali bazičnost vodnega okolja, kar povzroči karboksilno kislino ali karboksilatno sol:
Vam lahko služi: ravnovesje med tekočino in hlapomRCN + 2H2O + HCl → RCOOH + NH4Cl
RCN + H2O + NaOH → RCONA + NH3
V tem procesu se oblikuje tudi amida.
Nitrili se z vodikovimi in kovinskimi katalizatorji zmanjšajo na amine:
RCN → RCH2Nh2
Nomenklatura
V skladu z nomenklaturo IUPAC se nitrili poimenujejo tako, da v ime alkanske verige dodamo pripono -nitril, iz katere izhaja, vključno z ogljikom ciano. Tako, cho3CN se imenuje etanonitrilo in cho3Pogl2Pogl2CN, butanonitrile.
Lahko jih imenujemo tudi iz imena karboksilne kisline, ki jo izloči beseda "kislina", pripone pa so zamenjane -oic ali -oico s pripono -nitrile. Na primer za ch3CN bi bil acetonitril (ocetna kislina); Za c6H5CN, to bi bil benzonitril (benzojske kisline); In zanj (Cho3)2CHCN, 2-metilpropanitril.
Če upoštevamo imena nadomestkov alkikov, lahko nitrile omenjamo z besedo "cianid". Na primer CHO3CN bi se nato imenovali metil cianid in (CHO3)2Chcn, izopropil cianid.
Prijave
Nitrile so del naravnih proizvodov, ki so v grenkih mandljih, v kosteh različnih sadja, pri morskih živalih, rastlinah in bakterijah.
Njegove skupine CN sestavljajo strukture cianogenih lipidov in glikozidov, biomolekul, ki ob degradiranem sproščanju vodikovega cianida, HCN, zelo strupenega plina. Zato imajo skorajšnjo biološko uporabo za določena bitja.
Prej je bilo rečeno, da CN skupine dajejo molekulam veliko polarnosti, pravzaprav pa ne ostanejo neopažene, ko so prisotne v spojinah s farmakološko aktivnostjo. Takšna nitrilna zdravila so bila uporabljena za boj proti hiperglikemiji, raku dojke, diabetesa, psihoze, depresije in drugih motenj.
Vam lahko služi: nepopravljiva reakcija: značilnosti in primeriIn addition to having a role in biology and medicine, they industrially make up a handful of nitrile plastics, with which surgical and laboratory gloves are made, stamps of automotive parts, hoses and joints due to their resistance against corrosion and fats, Materials such as Tupperware, glasbeni inštrumenti ali bloki Legos.
Primeri nitrila
Naslednji in končno nekaj primerov nitrilov bo navedenih.
Nitrile gume
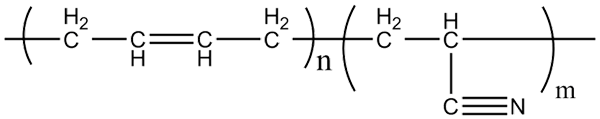 Molekularna struktura kopolimerov akrilonitrila-butadiena. Vir: Klever prek Wikipedije.
Molekularna struktura kopolimerov akrilonitrila-butadiena. Vir: Klever prek Wikipedije. Nitrilna guma, s katero se proizvajajo zgoraj omenjeni rokavici in materiali, ki so odporni na maščobe. Upoštevajte, kako izgleda linearna skupina CN.
CiameMazine
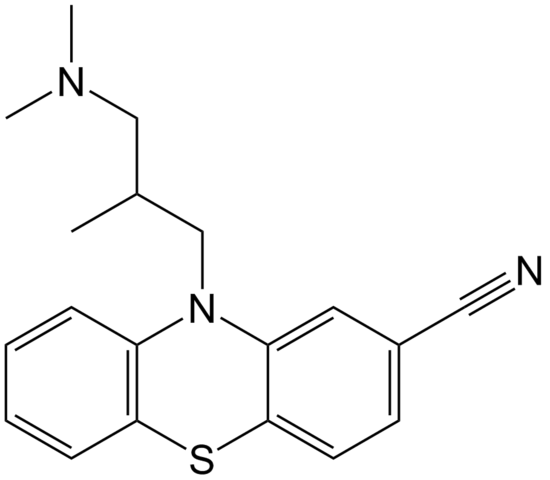 Molekularna struktura cipemazina. Vir: domena EPOP / pub
Molekularna struktura cipemazina. Vir: domena EPOP / pub Cimammazin je primer nitrila na območju lekarne, ki se uporablja kot antipsihotik, zlasti za zdravljenje motenj tesnobe in shizofrenije. Ponovno upoštevajte linearnost skupine CN.
Citalopram
 Drugo nitrilno zdravilo je citalopram, ki se uporablja kot antidepresiv
Drugo nitrilno zdravilo je citalopram, ki se uporablja kot antidepresiv Amigdalin
 Molekularna struktura tonzilina. Vir: Wesalius / javna domena
Molekularna struktura tonzilina. Vir: Wesalius / javna domena Tonzil je primer cianogene glucóside. Najdemo ga v grenkih mandljih, slivah, marelih in bremeh. Upoštevajte, kako majhna je videti skupina CN glede preostale strukture; Kljub temu je njegova enojna prisotnost dovolj, da zagotovi edinstveno kemično identiteto za ta ogljikovo hidrat.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Wikipedija. (2020). Nitril. Pridobljeno iz: v.Wikipedija.org
- Kemija librettexts. (5. junij 2019). Kemija nitrilov. Okrevano od: kem.Librettexts.org
- Jim Clark. (2016). Hidroliziranje nitrilov. Okrevano od: Chemguide.co.Združeno kraljestvo
- Ivy Rose Holistic. (2020). Poimenovanje nitrila. Pridobljeno iz: iVyrose.com
- Germán Fernández. (s.F.). Nomenklatura nitrila: pravila IUPAC. Okrevano od: Chemicicaorganica.org
- « 8 glavnih psiholoških tokov in njihovih avtorjev
- Metilaminska struktura, lastnosti, proizvodnja, uporabe »

