Metilaminska struktura, lastnosti, proizvodnja, uporabe
- 3987
- 192
- Roman Schamberger
The Metilamin Je organska spojina, katere kondenzirana formula je CHO3Nh2. Natančneje je najpreprostejši primarni alkiamin od vseh, saj vsebuje le alkično substituent, kar je isto, kot da obstaja samo ena kovalentna povezava C-N.
V normalnih pogojih gre za amonijanski plin, ki diši po ribah, vendar je to razmeroma enostavno kondenzirati in prevažati v hermetičnih rezervoarjih. Prav tako ga je mogoče občutno raztopiti v vodi, kar povzroča rumenkaste rešitve. Po drugi strani pa ga lahko tudi v obliki vaše kloridne soli, ch3Nh2· HCl.
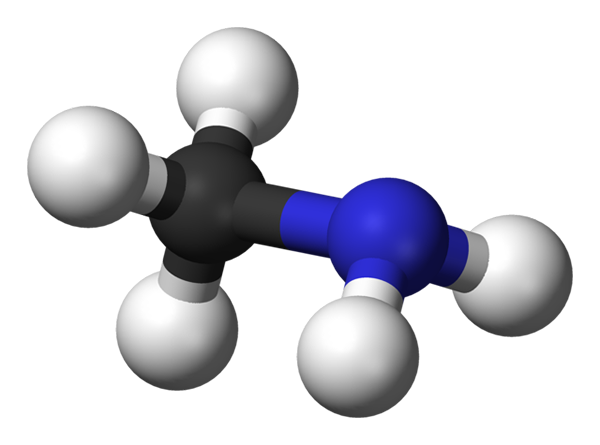
 Molekula metalamina. Vir: Benjah-BMM27 prek Wikipedije.
Molekula metalamina. Vir: Benjah-BMM27 prek Wikipedije. Metilamin se pojavlja v industrijskem iz amoniaka in metanola, čeprav na laboratorijskih lestvicah obstaja veliko drugih proizvodnih metod. Njen plin je zelo eksploziven, zato lahko vsak vir toplote, ki je blizu njega.
Gre za spojino z visokim komercialnim povpraševanjem, hkrati pa predstavlja močne pravne omejitve, ker služi kot surovina za droge in psihotropne snovi.
[TOC]
Struktura
Zgornja slika prikazuje molekularno strukturo metilamina, ki jo predstavlja model sfer in palic. Črna krogla ustreza atomu ogljika, modro z dušikovim atomom in belo do vodikovih atomov. Je torej majhna molekula, kjer je metan, cho4, Izgubite h za skupino NH2, dajanje pog3Nh2.
Metilamin je zelo polarna molekula, saj atom dušika privlači elektronsko gostoto ogljika in vodikove atome. Lahko tudi tvori vodikove mostove med zbirko svojih medmolekulskih sil. Vsaka molekula ch3Nh2 Lahko podarite ali sprejmete zaporedni vodikov most (ch3Hnh-nh2Pogl3).
Vam lahko služi: kaj je teorija benda?Vendar je njegova molekularna masa poleg pristanišč CH precej nizka tudi3 Ovirajo takšne vodikove mostove. Rezultat tega je, da je metilamin plin v normalnih pogojih, vendar ga je mogoče kondenzirati pri temperaturi -6 ° C. Pri kristalizaciji to stori po ortrorombični strukturi.
Lastnosti
Fizični videz
Barvit plin ali tekočina, katerih vodne raztopine lahko predstavljajo rumenkaste tone.
Vonj
Neprijetno, podobno kot mešanica rib in amoniaka.
Molarna masa
31.058 g/mol
Tališče
-93,10 ° C
Vrelišče
Okoli -6 ° C. Zato je plin, ki se lahko kondenzira pri ne prehladni temperaturi.
Gostota
656,2 kg/m3 pri 25 ° C. Njeni hlapi so 1,1 -krat goste kot zrak, medtem ko je njegova tekočina ali kondenzat približno 0,89 -krat manj gosta kot voda.
Parni tlak
Pri sobni temperaturi vaš parni tlak znaša 3,5 atm.
Dipolarni trenutek
1,31 d
Topnost vode
1.080 g/l pri 20 ° C. To je plin, ki se zelo dobro raztopi v vodi, saj sta obe molekuli polarni in med seboj povezani pri vzpostavljanju vodikovih mostov (ch3Hnh-oh2).
Basicy
Metilamin ima osnovno konstanto (PKb) od 3.36. Ta vrednost kaže, da gre za bistveno osnovno snov, celo več kot isti amoniak, zato se je raztopila v vodi sprostila določeno količino OH ionov- Ko je hidroliziran:
Pogl3Nh2 + H2Ali ⇌ ch3Nh3+ + Oh-
Metilamin je bolj osnoven kot amonijak, ker ima njen dušikov atom večje elektronske gostote. To je zato, ker CHO3 Naredili več dušikovih elektronov kot trije vodikovi atomi v molekuli NH3. Kljub temu se metilamin šteje za šibko podlago pred drugimi alkiamini ali amini.
Vam lahko služi: Vrsta povezave CO2Plamenišče
-10 ° C do zaprte skodelice, kar pomeni, da je zelo vnetljiv in nevaren plin.
Temperatura samostojnosti
430 ° C
Površinska napetost
19,15 mn/m a 25 ° C
Razgradnja
Ko opekline, se toplotno razgradi v ogljikovih in dušikovih oksidih, ki tvorijo strupeni dim.
Proizvodnja
Metilamin se lahko proizvaja ali sintetizira s komercialno ali industrijsko metodo ali z laboratorijskimi metodami na nižji lestvici.
Industrijsko
Metilamin se pojavlja v industrijsko reakcijo, ki poteka med amoniakom in metanolom na katalitični simpatični podpori gela. Kemična enačba za to reakcijo je naslednja:
Pogl3OH + NH3 → pogl3Nh2 + H2Tudi
V procesu se lahko ustvarijo drugi alkamini; Vendar je metyilamin izdelek, ki je kinenetsko bolj favoriziran.
Laboratorij
Na laboratorijski ravni obstaja več metod, ki omogočajo sintezo majhnega metilamina. Eden od njih je reakcija v močnem osnovnem mediju, koh, med acetamidom in bromom, med katerim se nastaja metil izocinat, ch3NCO, ki je hidrolizirana, da postane metilacija.
Metilamin lahko shranimo kot trdno, če nevtraliziramo s klorovodikovo kislino, tako da nastanejo tvorbe kloridne soli:
Pogl3Nh2 + Hcl → ch3Nh2· HCl
Nato je metilamin hidroklorid predstavljen tudi kot [CH3Nh3] CL, lahko temelji na varnem mestu za pridobitev vodne raztopine z raztopljenim plinom:
[Pogl3Nh3] Cl + NaOH → CH3Nh2 + NaCl + H2Tudi
Po drugi strani pa metilamin lahko sintetiziramo tudi iz heksamina (ch2)6N4, ki je neposredno hidroliziran s klorovodikovo kislino:
Vam lahko služi: kristalizacija(Pogl2)6N4 + HCl + 6 h2O → 4 nh4Cl + 6 ch2Tudi
Amonijev klorid zaporedno reagira z vročim formaldehidom, da povzroči hlape metilamina in mravljinčenja, hcooh.
Tudi metilamin lahko dobimo z zmanjšanjem nitrometana, CH3Ne2 s kovinskim cinkom in klorovodikovo kislino.
Prijave
 Efedrin je zdravilo, ki potrebuje metilamin za komercialno proizvodnjo. Vir: Turkeyphant.
Efedrin je zdravilo, ki potrebuje metilamin za komercialno proizvodnjo. Vir: Turkeyphant. Metilamin je spojina, katere uporabe običajno ustvarjajo polemiko, saj je snov, ki se uporablja pri sintezi narkotikov, kot je metamfetamin. Pravzaprav je njegova priljubljenost posledica želje, da bi jo morali protagonisti The Breaking Bad Television serije dobiti za vsako ceno.
Ta spojina se uporablja tudi kot surovina za proizvodnjo insekticidov, zdravil, površinsko aktivnih snovi, eksplozivov, barvil, fungicidov, aditivov itd., Torej ima močno svetovno povpraševanje, poleg več pravnih omejitev za njegovo pridobitev.
Njegova ogromna kemična vsestranskost je posledica molekule CHO3Nh2 To je dobro nukleofilno sredstvo, povezano ali usklajeno s substrati večje molekulske mase v več organskih reakcijah. Na primer, to temelji na sintezi efedrina, kjer CHO3Nh2 Pridruži se molekuli s posledično izgubo h.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). Metilamin. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Metilamin. Baza podatkov Pubchem., Cid = 6329. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Dylan Matthews. (15. avgust 2013). Tukaj je tisto, kar 'Breaking Bad' postane prav in narobe, glede meta. Okreval od: Washingtonpost.com
- Prepchem. (2020). Priprava metilamina hidroklorida. Okreval od: Prepchem.com

