Cinkova nitratna struktura, lastnosti, pridobivanje, uporabe

- 4259
- 985
- Cary Goyette
On cink nitrat To je anorganska spojina, ki jo tvorijo elementi cinka (Zn), dušika (N) in kisika (O) (O). Oksidacijski status cinka je +2, dušik je +5, kisik.
Njegova kemična formula je Zn (ne3)2. To je trden brezbarven kristalni, ki ponavadi absorbira vodo iz okolja. Dobimo ga lahko z obdelavo cinkove kovine z razredčeno dušikovo kislino. Je močno oksidacijska spojina.
 FIFR Zn nitrate (št3)2. Ondřej mangl / pub domena. Vir: Wikimedia Commons.
FIFR Zn nitrate (št3)2. Ondřej mangl / pub domena. Vir: Wikimedia Commons. Služi kot pospeševalnik organskih kemijskih reakcij in vam omogoča, da pridobite sestavljene polimere z električno energijo. Uporablja se za oblikovanje plasti uporabnih materialov v elektroniki.
Je del nekaterih tekočih gnojil in določenih herbicidov s počasnim izpuščanjem. Pomoč pri pripravi kompleksnih oksidov, ki izboljšajo vašo gostoto in električno prevodnost.
Uspešno je bil testiran pri pridobivanju struktur, ki služijo kot osnova za regeneracijo in rast kostnega tkiva, izboljšanje tega procesa in posledica antibakterijskega.
Čeprav ni gorivo, lahko pospeši kurjenje snovi, kot so premog ali organski materiali. To je dražilna koža, oči in sluznice in je zelo strupena za vodno življenje.
[TOC]
Struktura
Cinkov nitrat je ionska spojina. Ima dvovalentno kation (Zn2+) in dva monovalentna aniona (ne3-). Nitratni anion je poliatomski ion, ki ga tvori atom dušika v njegovem oksidacijskem stanju +5, pritrjen na tri atome kisika z Valencijo iz -2.
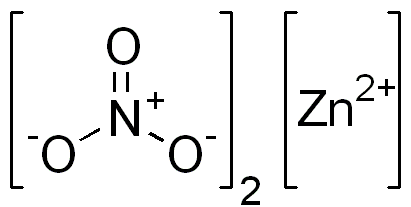 Ionska nitratna struktura cinka. Edgar181 / pub domena. Vir: Wikimedia Commons.
Ionska nitratna struktura cinka. Edgar181 / pub domena. Vir: Wikimedia Commons. Spodnja slika prikazuje prostorsko strukturo te spojine. Siva osrednja sfera je cink, modre krogle so dušik in rdeče krogle predstavljajo kisik.
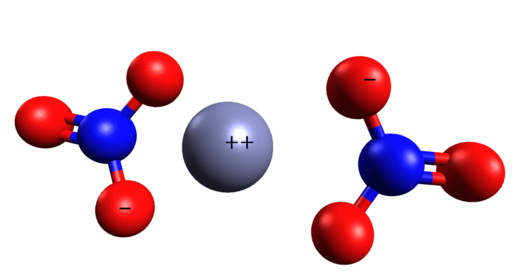 Prostorska struktura Zn (št3)2. Cinc je sredi nitratnih ionov. Grasso luigi/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Prostorska struktura Zn (št3)2. Cinc je sredi nitratnih ionov. Grasso luigi/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Nomenklatura
- Cinc nitrate
- Cink dinitrat
Lastnosti
Fizično stanje
Brezbarvna trdna ali kristalno bela.
Molekularna teža
189,40 g/mol
Tališče
Približno 110 ° C.
Lahko vam služi: iarhidric kislina (HI): struktura, lastnosti in uporabeVrelišče
Približno 125 ° C.
Gostota
2.065 g/cm3
Topnost
Voda topna: 120 g/100 g h2Ali pri 25 ° C. Alkohol topen.
ph
Njegove vodne raztopine so kisle. 5% raztopina ima pH približno 5.
Kemične lastnosti
Za to, da je nitrat, je ta spojina močan oksidant. Silovito reagira s premog, bakrom, kovinskimi sulfidi, organskimi snovmi, fosforjem in žveplom. Če je razpršena na vroče izkoriščanje premoga.
Po drugi strani je higroskopska in absorbira vodo iz okolja. Če tvorijo cinkov oksid, dušik in dioksid s kisikom:
2 Zn (št3)2 + toplota → 2 ZnO + 4 št2↑ + o2↑
V alkalnih raztopinah, kot so NaOH, cink te sestavljene tvori hidroksid in druge zapletene vrste:
Zn (št3)2 + 2 Oh- → Zn (OH)2 + 2 Ne3-
Zn (OH)2 + 2 Oh- → [Zn (OH)4]2-
Pridobivanje
Dobimo ga lahko z obdelavo cinkovega ali cinkovega oksida z razredčeno dušikovo kislino. V tej reakciji nastane vodikov plin.
Zn + 2 hno3 → Zn (št3)2 + H2↑
Prijave
Kataliza reakcij
Uporablja se kot katalizator pri pridobivanju drugih kemičnih spojin, kot so smole in polimeri. Je kisli katalizator.
 Primer smole. Bugman na angleški Wikipediji / javna domena. Vir: Wikimedia Commons.
Primer smole. Bugman na angleški Wikipediji / javna domena. Vir: Wikimedia Commons.  Model polimerne strukture. Ilmari Karonen / pub domena. Vir: Wikimedia Commons.
Model polimerne strukture. Ilmari Karonen / pub domena. Vir: Wikimedia Commons. Drug primer pospeška reakcij je katalitični sistem Zn (št3)2/VOC2Tudi4, kar omogoča oksidacijo α-hidrolisterjev do α-Zo-stresa z 99% pretvorbo tudi pri okoljskem tlaku in temperaturi.
V sestavljenih polimerih
Polimetilmetakrilat in Zn so razviti (ne3)2 Z električnimi prevodnimi lastnostmi, zaradi katerih so ustrezni kandidati za uporabo v superkavcih in računalnikih z veliko hitrostjo.
V cementih s kisisti
Z vodnimi raztopinami cinkovega nitrata in cinkovim oksidnim prahom dobimo materiale, ki pripadajo razredu cementa, ki nastanejo z reakcijo kisline.
Ti imajo razumno odpornost na raztopljenje v razredčenih kislinah in alkaliji, kar razvija stiskanje odpornosti v primerjavi z drugim cementom.
Ta lastnost se poveča, ko se poveča razmerje ZnO/Zn (ne3)2, In ko je koncentracija Zn naložena (ne3)2 V raztopini. Pridobljeni cementi so popolnoma amorfni, to pomeni, da nimajo kristalov.
Vam lahko služi: kemične padavine Z cinkovim nitratom so bili izvedeni testi za pridobivanje cementov. Avtor: Kobthanapong. Vir: Pixabay.
Z cinkovim nitratom so bili izvedeni testi za pridobivanje cementov. Avtor: Kobthanapong. Vir: Pixabay. V premazih in nanomaterialih cinkovega oksida
Zn (ne3)2 Uporablja se za elektrolitsko odlaganje zelo tankih plasti cinkovega oksida (ZnO) na različnih podlagah. Na nanostrukturi tega oksida so pripravljene tudi na površinah.
 Nanodelci cinkovega oksida. Nekatere nanostrukture ZnO lahko pripravite z Zn (ne3)2. Verena Wilhelmi, Ute Fischer, Heike Weighardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmetke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/cc by (https: // creativeCommons.Org/licence/by/2.5). Vir: Wikimedia Commons.
Nanodelci cinkovega oksida. Nekatere nanostrukture ZnO lahko pripravite z Zn (ne3)2. Verena Wilhelmi, Ute Fischer, Heike Weighardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmetke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/cc by (https: // creativeCommons.Org/licence/by/2.5). Vir: Wikimedia Commons. ZnO je material, ki ga zanimajo zaradi množice aplikacij na področju optolektronike, ima tudi polprevodniške lastnosti in se uporablja pri senzorjih in pretvornikih.
V herbicidih
CINC nitrat je bil uporabljen skupaj z nekaterimi organskimi spojinami za zmanjšanje hitrosti sproščanja nekaterih herbicidov v vodi. Počasna izdaja teh izdelkov jim omogoča, da so na voljo za daljše in manjše aplikacije so potrebne.
V proizvodnji ANOD
Spodbuja postopek sintranja in izboljša gostoto nekaterih oksidov, ki služijo za izdelavo anodov za gorivne celice. Sintranje pridobi trden material s pomočjo ogrevanja in stiskanja praška, ne da bi dosegli njegovo združitev.
 Risanje, kako se pojavi dve zrni. Zn (ne3)2 Pomoč pri izvajanju tega procesa na nekaterih zapletenih oksidih. Cdang / pub domena. Vir: Wikimedia Commons.
Risanje, kako se pojavi dve zrni. Zn (ne3)2 Pomoč pri izvajanju tega procesa na nekaterih zapletenih oksidih. Cdang / pub domena. Vir: Wikimedia Commons. Materiali, v katerih so bili opravljeni testi, so zapleteni oksidi stroncija, iridija, železa in titana. Prisotnost FAL znatno poveča električno prevodnost le -teh.
Druge aplikacije
Uporablja se pri pridobivanju zdravil. Deluje kot mordant pri uporabi črnil in barvil. Služi kot koagulant iz lateksa. Je vir cinka in dušika v tekočih gnojilih.
Potencialna uporaba v inženirstvu kostnega tkiva
Ta spojina je bila uporabljena kot dodatek pri izdelavi oklepa ali okvirjev za regeneracijo kostnih vlaken, saj omogoča izboljšanje mehanske odpornosti teh struktur.
Vam lahko služi: Germanio: Zgodovina, lastnosti, struktura, pridobivanje, uporabeOpazili so, da odri, ki vsebuje fift, ni strupeno za osteoprogenitorske celice, podpira aktivnost osteoblastov, ki so celice, ki proizvajajo kost, in izboljšujejo njihovo oprijem in širjenje.
Daje prednost tvorbi apatite, ki je mineral, ki tvori kosti in ima tudi antibakterijski učinek.
 Zn (ne3)2 Lahko bi bilo zelo koristno za obnovo kostnih snovi pri ljudeh, ki so doživeli nesreče. Mariano Coretti/CC BY-SA (https: // createCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Zn (ne3)2 Lahko bi bilo zelo koristno za obnovo kostnih snovi pri ljudeh, ki so doživeli nesreče. Mariano Coretti/CC BY-SA (https: // createCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Tveganja
Je material s potencialnim tveganjem za požar in eksplozijo.
Ni gorivo, ampak pospešuje kurjenje gorljivih materialov. Če je v požaru vključena velika količina te spojine ali če je gorljiv material fino razdeljen, se lahko pojavi eksplozija.
Ko so podvrženi močni vročini, nastanejo strupeni dušikovi oksidi. In če se izpostavljenost izvaja podaljša, lahko eksplodira.
Za kožo draži, lahko povzroči resne poškodbe oči, draženje v dihalnih poteh, strupena je zaradi zaužitja in povzroči poškodbe prebavnega trakta.
Zelo strupeno za vodno življenje z učinki, ki trajajo.
Reference
- Ju in. et al. (2019). Nov učinek cinkovega nitrata/vanadil oksalata za selektivno katalitično oksidacijo alfa-hidroksi estrov na alfa-keto esers z molekularnim kisikom: in situ. Molekule 2019, 24, 1281. MDPI se je okreval.com.
- Mohd s., S.N. et al. (2020). Nadzorovano formulacijo cinkovega hidroksidnega nitrata, interkaliranega z natrijevim dodecilsulfe in Bispiribac Anions: nov herbicid nanokompozit za gojenje neoluščenih neoluščenih. Arabski časopis za kemijo 13, 4513-4527 (2020). Okrevano od Scientirect.
- Človek, m.Str. et al. (2019). Obogatena mehanska trdnost in mineralizacija kosti biomimetičnih odrov elektrospona, obremenjenega z oljem Ylang Ylang in cinkovim nitratom za inženirstvo kostnega tkiva. Polimerji 2019, 11, 1323. MDPI se je okreval.com.
- Kim, k.Yo. et al. (2018). Učinki cinkovega nitrata kot sintranja na elektrokemijske značilnosti SR0,92In0,08Stric3-delta in g0,92In0,08Ti0,6Vera0,4Tudi3-delta Ceramics International, 44 (4): 4262-4270 (2018). Okrevano od Scientirect.com.
- Prasad, b.In. et al. (2012). Elektrodepozicija ZnO prevleke iz vodne Zn (št3)2 Kopeli: Vpliv koncentracije Zn, odlaganje temperature in čas na orientacijo. J Solid State Elcochem 16, 3715-3722 (2012). Povezava je bila obnovljena.Springer.com.
- Bahadur, h. in Srivastava,.K. (2007). Morfologije sol-gel izčrpanih tankih filmov ZnO z uporabo različnih predhodnih materialov in njihovih nanostruktur. Nanoscale Res Lett (2007) 2: 469-475. Povezava je bila obnovljena.Springer.com.
- Nicholson, J.W. in tibaldi, j.Str. (1992). Tvorba in lastnosti cementa, pripravljene iz cinkovega oksida in vodnih raztopin cinkovega nitrata. J Mater Sci 27, 2420-2422 (1992). Povezava je bila obnovljena.Springer.com.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Maji, str. et al. (2015). Vpliv Zn (št3)2 Polnilo na dielektrični demillity in električni modul PMMA. Bull Mater Sci 38, 417-424 (2015). Povezava je bila obnovljena.Springer.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Cink nitrat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- ByJU's. (2020). Cinkov nitrat - Zn (NO3) 2. Okreval od Byjusa.com.
- Ameriški elementi. Cink nitrat. Okrevana od ameriških.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- « Struktura cinkovega klorida (Zncl2), lastnosti, pridobivanje, uporabe
- Konkretni primeri etičnega postopka v institucijah in organizacijah »

