Struktura cinkovega klorida (Zncl2), lastnosti, pridobivanje, uporabe

- 2524
- 583
- Cary Goyette
On cinkov klorid Gre. Njegova kemična formula je Zncl2. CINC najdemo v stanju oksidacije +2 in klor ima Valencia -1.
Je brezbarvna ali bela kristalna trdna. V vodi je zelo topen in ga zlahka absorbira iz okolja, kar je mogoče videti na sliki navlažene trdne snovi, prikazane spodaj.
 FIFCL klorid2 trdno nekoliko hidrirano. Uporabnik: Walkerma / Public Domain. Vir: Wikimedia Commons.
FIFCL klorid2 trdno nekoliko hidrirano. Uporabnik: Walkerma / Public Domain. Vir: Wikimedia Commons. Cink te spojine je biološko zelo pomemben za ljudi, živali in rastline, saj posega v osnovne funkcije, kot sta sinteza beljakovin in maščob.
Zaradi tega Zncl2 Uporablja se kot prehransko dopolnilo živalim in ljudem v primerih pomanjkanja cinka in kot mikrohranil za rastline.
Ima bakteriostatične in adstrigentne lastnosti in se v teh namenih pogosto uporablja tako v človeški kot v veterinarski medicini. Odpravlja tudi škodljivce, kot so zunanje glive in je posrednik za pridobivanje pesticidov.
Med večkratno uporabo, ki jo služi za zdravljenje celuloznih in volnenih vlaken v različnih procesih, pa tudi za pripravo na barvo ali tiskanje. Prav tako odložite zgorevanje lesa.
[TOC]
Struktura
Zncl2 To je ionska spojina, ki jo tvori kation Zn2+ in dva aniona klorida Cl- ki se vežejo skozi elektrostatične sile.
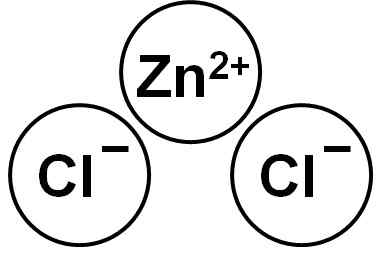 Cinkov klorid. Avtor: Marilú Stea.
Cinkov klorid. Avtor: Marilú Stea. Cink (ii) ion ima naslednjo elektronsko strukturo:
1s2, 2s2 2 p6, 3s2 3P6 3D10, 4s0,
v katerem opazimo, da sta oba elektrona rt 4s, pri čemer je konfiguracija stabilna.
Kloridni ion predstavlja naslednjo strukturo:
1s2, 2s2, 2 p6, 3s2 3P6,
ki je tudi zelo stabilen za popolne orbitale.
Na sliki lahko opazimo način, kako so ioni na voljo v steklu. Sive sfere predstavljajo cink in zelene kroglice do klora.
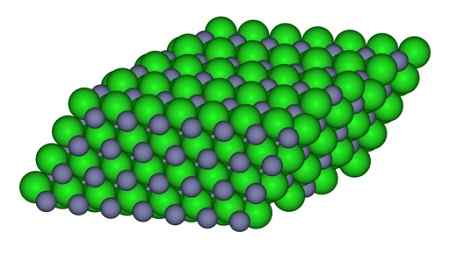 Struktura, ki tvori ione v kristalu ZnCl2. CCOIL/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Struktura, ki tvori ione v kristalu ZnCl2. CCOIL/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. Nomenklatura
- Cinkov klorid (ii)
- Cink diklorid
Lastnosti
Fizično stanje
Brezbarvna trdna ali kristalno bela. Šesterokotni kristali.
Molekularna teža
136,3 g/mol
Tališče
290 ° C
Vrelišče
732 ° C
Gostota
2.907 g/cm3 pri 25 ° C
Topnost
Zelo topno v vodi: 432 g/100 g h2Ali pri 25 ° C, 614 g/100 g H2Ali 100 ° C. Zelo topno v klorovodiki (HCl), alkoholu in glicerolu. Popolnoma mešljivo.
Vam lahko služi: živosrebrni hidroksid: struktura, lastnosti, uporabe, tveganjaph
Njegove vodne raztopine so kisle. Raztopina 6 molov Zncl2/L ima pH 1,0.
Kemične lastnosti
Gre. V vodi je hidroliziran in ima nagnjenost k oblikovanju osnovnega netopnega cinkovega oksiklorida.
Reagira s cinkovim oksidom (ZnO) v vodi, ki ustvarjajo cinkovi oksikloridi, ki predstavljajo izjemno trdo cementno material.
Je nežno jedko do kovin.
Ni vnetljivo.
Biološka vloga
Biološko cink je eden najpomembnejših elementov. Prepoznan je kot bistvenega pomena za vse življenjske načine.
V človeškem telesu je Zncl2 Zn zagotavlja, kar je ključnega pomena za sintezo beljakovin, holesterola in maščob. Zlasti CINC je pomemben za pravilno delovanje imunskega sistema.
 Cink Zncl2 Pomembno je za delitev celic pri živih bitjih. Ladyofhats / javna domena. Vir: Wikimedia Commons.
Cink Zncl2 Pomembno je za delitev celic pri živih bitjih. Ladyofhats / javna domena. Vir: Wikimedia Commons. Ugotovljenih je bilo več kot 25 beljakovin, ki vsebujejo cink.
Pomanjkanje CIC -a lahko med drugim privede do rasti rasti, depresivne duševne funkcije, anoreksije, dermatitisa, zmanjšanja imunosti, driske in slabega nočnega vida.
Pridobivanje
Komercialno to spojino pripravimo tako, da reagiramo vodno klorovodikovo kislino z odpadki, cinkovimi odpadki ali z mineralom, ki ga vsebuje. V tej reakciji je tudi plinski vodik (h2).
Dobimo zdravljenje cinka z vodikovim kloridom pri 700 ° C.
Zn + HCl → Zncl2 + H2↑
Prijave
Pri terapevtskih tretmajih
Gre za mehko ali bakteriostatično antibakterijsko, zato se uporablja v vaginalnih tušah za odpravo okužb s trikomonami ali hemofilom. Služi tudi za zdravljenje kalusov, kot adstrigentno in v kemocirugiji pri kožnem raku.
Uporablja se kot adstrigent v nekaterih kozmetiki, kot je osvežilni losjoni za kožo.
Kot prehransko dopolnilo
Zaradi pomembnosti v različnih funkcijah človeškega organizma Zncl2 Uporablja se ustno kot del prehranskih dodatkov in tudi pri ljudeh, ki potrebujejo parenteralno hrano.
Dodatki Zncl2 Na voljo so za obdelavo cone.
Vam lahko služi: homogena mešanica Dodatki Zncl2 Uporabiti jih je treba, kadar pride do pomanjkanja cinka. Avtor: Moakets. Vir: Pixabay.
Dodatki Zncl2 Uporabiti jih je treba, kadar pride do pomanjkanja cinka. Avtor: Moakets. Vir: Pixabay. Zdravi posamezniki ga pridobijo s hrano.
Dobiti ga je treba vsaj 1 uro pred obroki ali 2 uri po teh, saj lahko nekatera hrana prepreči njihovo absorpcijo. Pri bolnikih, ki imajo draženje želodca po dopolnjenem zaužitju, bi ga morali zaužiti z obroki, na ta način.
V veterinarskih aplikacijah
Njegove rešitve so bile pri živalih uporabljene kot kavstično sredstvo za kurjenje ali tesnilo fistule, ki so povezave med organi, ki niso normalni ali zdravi; V obliki testenin služi za zdravljenje razjed in kemoterapije z rakom.
 Vodne rešitve Zncl2 Uporabljajo se za zdravljenje okužb z živalmi. Avtor: Mabel Amber. Vir: Pixabay.
Vodne rešitve Zncl2 Uporabljajo se za zdravljenje okužb z živalmi. Avtor: Mabel Amber. Vir: Pixabay. Pri očesnih okužbah zelo razredčena raztopina te spojine deluje kot antiseptik in adstrigentna.
Uporablja se tudi kot sledi v krmi živali ali kot prehrambeni dodatek.
V posebnih cementih
Reakcija med Zncl2 In ZnO v vodi proizvaja nekaj cinkovega oksiklorida, ki sestavljajo izjemno trd ali cementni material. Glavne sestavine so 4ZNO • Zncl2• 5H2O in ZnO • Zncl2• 2H2Tudi.
Ta vrsta cementov se upira napadu kisline ali vrele vode. Vendar je pentahidrat zelo stabilen in netopen, vendar nespremenljiv, dihidrat.
Zaradi tega imajo ti cementi malo aplikacij.
Kot katalizator
Služi za pospešitev nekaterih organskih reakcij kemije. Deluje kot kondenzacijski agent. Na primer, v aldolskih reakcijah, reakcijah aminacije in dodajanju ciklov. V nekaterih od teh dejanj kot radikalni pobudnik.
Gre. Uporablja se tudi kot katalizator v reakcijah Friedel-Crafts, za proizvodnjo barvil in barvil ter pri proizvodnji poliestrskih političnih smol.
Spodaj je reakcija, v kateri se ta spojina vmeša:
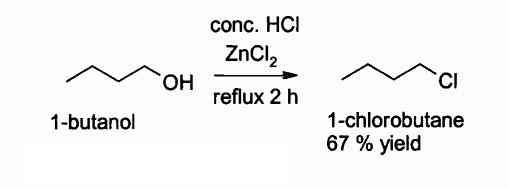 Reakcija pridobivanja alkil klorida z uporabo Zncl2. Avtor: Walkerma. Vir: Wikimedia Commons.
Reakcija pridobivanja alkil klorida z uporabo Zncl2. Avtor: Walkerma. Vir: Wikimedia Commons. V kmetijskih dejavnostih
Za odpravo škodljivcev, kot sta glive in mah, se uporablja kot herbicid v pridelkih, kot listno zdravljenje, in kot mikrohranil. Posrednik je priprava pesticidov.
V zobnih aplikacijah
Uporablja se v pranju iz ust, vendar je priporočeni čas stika zelo kratek, zato deluje le kot adstrigent v ustni sluznici. Služi kot desenzibilizator, uporablja se v dentifrovih pastah in je del zobnih cementov.
Vam lahko služi: natrijev klorit (NaClo2): struktura, lastnosti, uporabe, tveganjaV tekstilni in papirni industriji
Je sestavina topila, ki se uporablja pri proizvodnji rajona ali umetne svile iz celuloze. Gre. Služi tudi za njihovo zdravljenje in daje prednost njihovi ohranitvi.
Omogoča zavijanje tkanin, ločeno svileno in volneno vlakno ter deluje kot mordant pri tiskanju in obarvanju tekstila.
Uporablja se pri izdelavi papirnatih drskov in za izdelavo krep papirja.
Pri pripravi nanodelcev
Z reakcijo cinkovega klorida z natrijevim sulfidom (NA2S) s sonokemično metodo in ob prisotnosti nekaterih organskih spojin nanodelci cinkovega sulfida (ZN) dobimo. Sonokemične metode uporabljajo zvočne valove, da povzročajo kemične reakcije.
Ta vrsta nanomaterialov bi lahko uporabila kot fotokatalitična sredstva za proizvodnjo, na primer delitev vode v njegovih komponentah (vodik in kisik) z delovanjem svetlobe.
V več aplikacijah
- Deodorant, antiseptik in razkužila območja. Nadzor mah, plesni in gliv v zunanjih sosednjih strukturah in območjih, kot so pločniki, dvorišča in ograje. Razkužilo stranišč, urina, preprog in stisnjenega lesa.
- Uporablja se v mešanicah za Embalmar in rešitve za ohranjanje anatomskih vzorcev.
- Leseni zaviralci plamena.
- Primarna sestavina dimnih črpalk, ki se uporabljajo za razprševanje številnih ljudi; Gasilci jih uporabljajo v vajah in praksah požara.
 Cinc klorid se uporablja v dimnih črpalkah, ki se uporabljajo v vojaških vajah. Ali.S. Ministrstvo za obrambo trenutni PhotosCpl. Abraham Lopez / 2. morska divizija / javna domena. Vir: Wikimedia Commons.
Cinc klorid se uporablja v dimnih črpalkah, ki se uporabljajo v vojaških vajah. Ali.S. Ministrstvo za obrambo trenutni PhotosCpl. Abraham Lopez / 2. morska divizija / javna domena. Vir: Wikimedia Commons. - Komponenta varilnega pretoka. V kovinskem snemanju. Za jekleno barvanje, pocinkano in železno furnirsko kopalniško komponento z bakrom.
- V magnezijevih in kovinskih cementih.
- Razbiti emulzije pri rafiniranju nafte. Agent v proizvodnji asfalta.
- Elektrolit v posušenih baterijah.
 Suha baterija Zncl2. Uporabnik: 32bitmaschine; Uredil uporabnik Jaybear/CC by-S (https: // createCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Suha baterija Zncl2. Uporabnik: 32bitmaschine; Uredil uporabnik Jaybear/CC by-S (https: // createCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. - Vulkanizacija gume.
- Dehidracijski agent.
Tveganja
Lahko povzroči opekline oči, kože in sluznice.
Ko se segreje na njegovo razgradnjo, oddaja strupeni vodikov klorid (HCl) in cinkov oksid (ZnO).
Opozorilo o njegovi uporabi kot drogam
Čeprav manjkajo dokončne študije, se ocenjuje, da če se ta spojina daje nosečnicam, lahko povzroči škodo na plodu. Toda potencialne koristi bi lahko imele večjo težo kot možna tveganja.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Kloridni cink. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Liska, m. et al. (2019). Poseben cement. Cinkov oksikloridni cement. V Lea -ovi kemiji cementa in betona (peta izdaja). Okrevano od Scientirect.
- Pohanish, r.Str. (2017). Kloridni cink. V SITTIG -ovem priročniku strupenih in nevarnih kemikalij in rakotvornic (sedma izdaja). Okrevano od Scientirect.com.
- Gedanken, a. in perelshtein, jaz. (2015). Ultrazvok moči za proizvodnjo nanomaterialov. V moči Ultrasonics. Okrevano od Scientirect.
- Archibald, s.J. (2003). Skupine prehodnih kovin 9-12. Reakcije in kataliza. Pri razumevanju koordinacijske kemije II. Okrevano od Scientirect.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- « Cinkova kromatna struktura, lastnosti, pridobivanje, uporabe
- Cinkova nitratna struktura, lastnosti, pridobivanje, uporabe »

