Bakreni nitrat (ii)
- 4433
- 868
- Raymond Moen
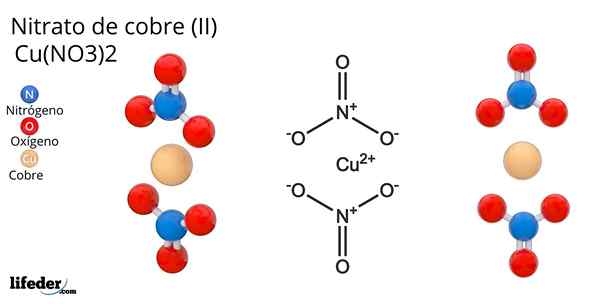
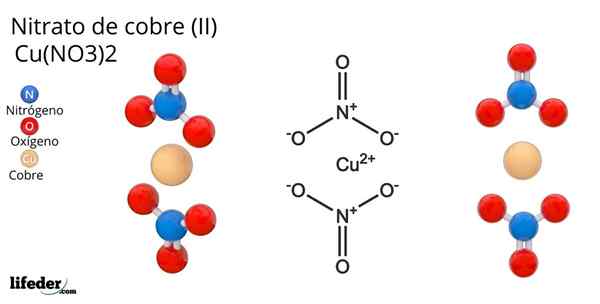 Formula in struktura bakrenega nitrata (II)
Formula in struktura bakrenega nitrata (II) On bakreni nitrat (Ii) ali cuPric nitrat, katerega kemična formula je Cu (ne3)2, Je briljantna anorganska sol in privlačne modro-zelene barve. Sintetizira se v industrijskem merilu iz razgradnje bakrenih mineralov, vključno z minerali Gerhardita in Rouaita.
Druge bolj izvedljive metode glede na surovine in želene količine soli so sestavljene iz neposrednih reakcij s kovinskim bakrom in njegovimi izpeljanimi spojinami. Ko je baker v stiku s koncentrirano raztopino dušikove kisline (HNO3), pride do redoks reakcije.
V tej reakciji se baker oksidira in dušik zmanjša glede na naslednjo kemijsko enačbo:
Cu (s) + 4hno3(conc) => cu (št3)2(AC) + 2H2Ali (l) + 2no2(g)
Dušikov dioksid (št2) je rjav in škodljiv plin; Nastala vodna raztopina je modrikasta. Baker lahko tvori cuprous ion (cu+), CuPric ion (Cu2+) ali najmanj pogost ion cu3+; Vendar pa v vodnih medijih v vodnih medijih ne naklonjeni številni elektronski, energijski in geometrijski dejavniki.
Standardni potencial za CU+ (0,52V) je večji kot pri Cu2+ (0,34V), kar pomeni, da je Cu+ Je bolj nestabilen in ponavadi osvoji elektron, da postane cu (s). Ta elektrokemijski ukrep pojasnjuje, zakaj ni cuno3 kot produkt reakcije ali vsaj v vodi.
[TOC]
Lastnosti bakra nitrata
 Videz bakrenega nitrata (II) Triohidrat
Videz bakrenega nitrata (II) Triohidrat Bakreni nitrat je anhidrid (suh) ali hidriran z različnimi deleži vode. Anhidrid je modra tekočina, toda po usklajevanju z molekulami vode - ki lahko tvori vodikove mostove - kristalizira, kako Cu (ne3)2· 3H2O o cu (ne3)2· 6H2Tudi. To so tri najbolj razpoložljive oblike soli na trgu.
Lahko vam služi: Helmholtz brezplačna energija: enote, kako se izračuna, rešene vajeMolekulska masa za suho sol je 187,6 g/mol, kar je do tega vrednosti dodajalo 18 g/mol za vsako molekulo vode, vgrajeno v sol. Njegova gostota je enaka 3,05 g/ml, zmanjšuje pa se z vsako vgrajeno molekulo vode: 2,32 g/ml za trihidrirano sol in 2,07 g/ml za hexa-hidrirano sol. Nima vrelišča, ampak sublima.
Tri oblike bakrenega nitrata so zelo topne v vodi, amoniaku, dioksanu in etanolu. Njegove talilne točke se spustijo, ko se zunanji koordinacijski sferi bakra dodajo še ena molekula; Fuziji sledi toplotna razgradnja bakrenega nitrata, ki proizvaja škodljive pline NO2:
2 Cu (št3)2(s) => 2 cuo (s) + 4 ne2(g)+ oz2(g)
Zgornja kemična enačba je za anhidridno sol; Za hidrirane soli se bo na desni strani enačbe pojavila tudi vodna para.
Elektronska konfiguracija
Elektronska konfiguracija za Ion Cu2+ Je [ar] 3d9, Predstavitev paramagnetizma (elektron v 3D orbitali9 je izginil).
Ker je baker prehodna kovina četrtega obdobja periodične tabele in je izgubila dva od svojih elektronov Valencije na delovanje HNO3, Še vedno ima na voljo 4S in 4p orbitale za oblikovanje kovalentnih obveznic. Še več, Cu2+ Če želite uskladiti do šest molekul, lahko uporabite dve najbolj zunanji 4D orbitali.
Anioni št3- So ravne in za CU2+ Lahko se usklajujete z njimi, mora imeti hibridizacijo SP3d2 To vam omogoča, da sprejmete oktaedrsko geometrijo; To preprečuje, da bi anioni ne3- biti "hit" med njimi.
Lahko vam služi: kondenzirana formula: kaj je in primeri (metan, etan, glukoza ...)To doseže Cu2+, jih postavite v kvadratno ravnino okoli sebe. Nastala konfiguracija za atom Cu znotraj soli je: [AR] 3D94s24p6.
Kemična struktura
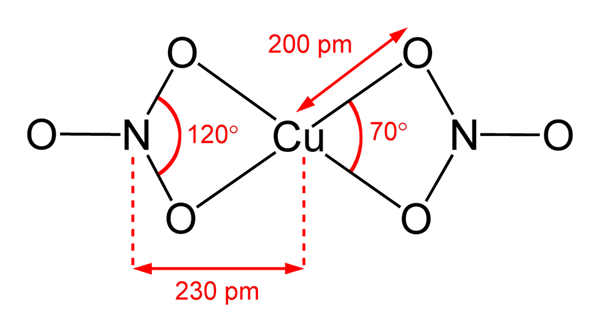 Struktura bakrene nitrate (ii)
Struktura bakrene nitrate (ii) Na vrhunski sliki je predstavljena izolirana molekula Cu (ne3)2 V plinski fazi. Atomi nitratnih aniona kisika so neposredno usklajeni s bakrenim centrom (notranja koordinacijska sfera), ki tvorijo štiri vezi Cu-O.
Ima molekularno geometrijo kvadratne ravnine. Letalo narišejo rdeče krogle v vrhovih in bakrena krogla v sredini. Plinasti fazni interakciji so zelo šibke zaradi elektrostatičnih odbojnosti med skupinami ne3-.
Vendar v trdni fazi bakreni centri tvorijo kovinske vezi -Cu-cu-, kar ustvarja polimerne koprivne verige.
Molekule vode lahko tvorijo vodikove mostove s skupinami ne3-, In ti bodo ponudili vodikove mostove za druge molekule vode in tako naprej, dokler ne kroge z vodo okoli Cu (ne3)2.
V tej sferi ima lahko od 1 do 6 zunanjih sosedov; Zato je sol zlahka hidrirana, da ustvari hidrirane tri in heksa soli.
Sol nastane iz iona Cu2+ in dva iona št3-, Podelitev značilne kristalnosti ionskih spojin (ortorrambično za anhidridno sol, Rhomboédica za hidrirane soli). Vendar so povezave večjega kovalentnega značaja.
Uporaba/aplikacije
Za očarljive barve bakrenega nitrata se ta sol uporablja kot dodatek v keramiki, na kovinskih površinah, v nekaterih ognjemetu in tudi v tekstilni industriji kot Mordant.
Vam lahko služi: entalpijaTo je dober vir ionske za številne reakcije, zlasti tiste, v katerih katalizira organske reakcije. Podobne uporabe najde tudi pri drugih nitratih, bodisi kot fungicid, herbicid ali kot leseni konzervansu.
Druga njegova glavna in najbolj nova uporaba je sinteza Cuo katalizatorjev ali materialov s fotosenzibilnimi lastnostmi.
Uporablja se tudi kot klasični reagent v poučevanju laboratorijev za prikaz reakcij znotraj voltaičnih celic.
Tveganja
- To je močno oksidacijsko sredstvo, škodljivo za morsko, dražilno, strupeno in korozivno ekosistem. Pomembno se je izogniti vsem fizičnim stikom neposredno z reagentom.
- Ni vnetljivo.
- Razpade pri visokih temperaturah, ki sproščajo razdražljive pline, med njimi2.
- V človeškem organizmu lahko povzroči kronično škodo centralnemu srčno -žilnemu in živčnemu sistemu.
- Lahko povzroči draženje v prebavilih.
- Biti nitrat, znotraj telesa postane nitrit. Nitrit vzbuja pustovanje v nivojih kisika v krvi in v srčno -žilnem sistemu.
Reference
- Dan, r., & Underwood, a. Kvantitativna analitična kemija (Peti izd.). Pearson Prentice Hall, P-810.
- Mel Science. (2015–2017). Mel Science. Okrevano od Mel Science: Melscience.com
- ResearchGate GmbH. (2008–2018). ResearchGate. Okrevano iz ResearchGate: Researchgate.mreža
- Znanstveni laboratorij. Znanstveni laboratorij. Obnovi se iz znanstvenega laboratorija: Sciencelab.com
- Whitten, Davis, Peck in Stanley. (2008). Kemija (Osmi izd.). P-321. Cengage učenje.
- Wikipedija. Wikipedija. Wikipedia je okrevala: v.Wikipedija.org

