Kemična struktura barijev nitrat, uporabe, lastnosti

- 781
- 38
- Mr. Shane Larkin
On Barijev nitrat Je sol, sestavljena iz barijevega atoma (BA) in nitratnega iona (ne3). Predstavljen je kot bela kristalna trdna snov pri sobni temperaturi in obstaja v naravi kot zelo redek mineral, znan kot Nitrobarita. Njene lastnosti naredijo strupeno spojino, ki jo je treba skrbno upravljati.
Pravzaprav ima ta spojina več načinov uporabe v vojaški industriji, saj jo je mogoče povezati z drugimi kemičnimi snovmi in med drugim dodati eksplozivnim in zažigalnim formulacijam.
 Videz barijev nitrat. Vir: w. Oelen/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0
Videz barijev nitrat. Vir: w. Oelen/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0 [TOC]
Formula
Barijev nitrat, imenovan tudi barijev ditrat, ima kemijsko formulo BA (št3)2, in se običajno izdeluje z dvema metodama.
Prvi od njih vključuje raztapljanje majhnih kosov barijevega karbonata (Bacchus3) V srednje -cidnem mediju (hno3, zelo jedko jedko mineralna kislina), ki omogoča oborino nečistoče železa, nato pa to zmes filtriramo, izhlapimo in kristaliziramo.
Druga metoda se izvede s kombinacijo barijevega klorida (BACL2, ena od barijevih soli večje topnosti v vodi) z predhodno ogreto raztopino natrijevega nitrata. To ustvari reakcijo, ki ima za posledico ločitev mešanice barijevih nitratnih kristalov.
Kemična struktura barijevega nitrata
Ta sol predstavlja značilnosti kubične kristalne strukture ali brezvodnih oktaedrov.
Njegova kemijska struktura je naslednja:
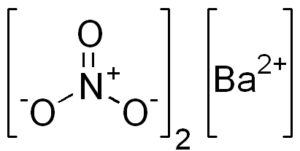
Disociacija
Pri visokih temperaturah (592 ° C) se barijev nitrat razgradi, da tvori barijev oksid (BAO), dušikov dioksid (št2) in kisik (ali2), V skladu z naslednjo kemijsko reakcijo:
Vam lahko služi: Beryl hidroksid (biti (OH) 2)2BA (št3)2 + Toplota → 2Bao + 4No2 +Tudi2
V medijih z visokimi koncentracijami dušikovega oksida (NO) razgradnja barijevega nitrata proizvaja spojino, imenovano barijev nitrit (BA (ne2)2), V skladu z naslednjo enačbo:
Kopalnica3)2 + 2No → BA (št2)2 + 22
Reakcije s topnimi kovinskimi ali žveplovimi kislinskimi sulfati (h2SW4) Ustvari barijev sulfat (baso4). Velika večina netopnih barijevih soli, kot je karbonat (Bacchus3), Oksalat (bac2Tudi4) ali kovinski fosfat (ba3(PO4)2), ki se oborijo s podobnimi reakcijami z dvojno razgradnjo.
Uporaba barijevega nitrata
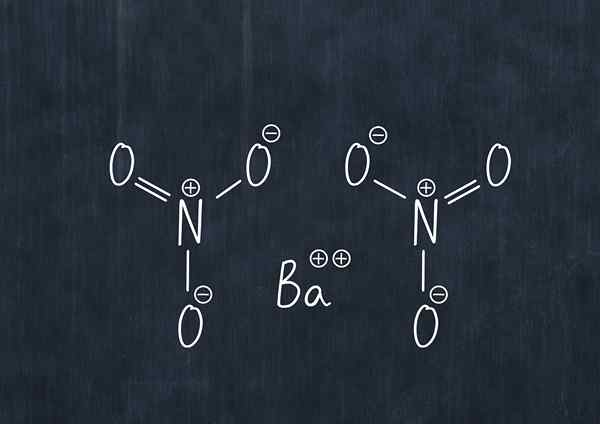 Kemična formula barijevega nitrata
Kemična formula barijevega nitrata Ta snov v prahu je oksidacijsko sredstvo in znatno reagira s skupnimi zmanjšanimi sredstvi.
Ko se ta sol meša z drugimi kovinami, kot sta aluminij ali cink. Zaradi tega barijev nitrat velja za odličen sestavni del vojaškega orožja in eksploziva.
Skupaj s trinitrotoluenom (komercialno znan kot TNT ali C6H2(Ne2)3Pogl3) in vezivo (redno parafinski vosek), ta sol tvori spojino, imenovano baratol, ki ima eksplozivne lastnosti. Visoka gostota barijevega nitrata povzroči, da baratol pridobi tudi večjo gostoto, zaradi česar je bolj učinkovit pri svoji funkciji.
Barijev nitrat se pridružuje tudi aluminijastemu prahu, formuli, ki ima za posledico nastanek utripajočega smodnika, ki se uporablja predvsem v ognjemetu in gledališki pirotehniki.
Ta utripa je opazila tudi uporabo pri proizvodnji plašč (na primer protimilskih ukrepov letala) in v omamljenih granatah. Poleg tega je ta snov zelo eksplozivna.
Lahko vam služi: natrijev cianid (NACN): struktura, lastnosti, tveganja, uporabeTa sol se kombinira z reakcijsko mešanico, imenovano Thermite, da tvori variacijo tega tako imenovanega termata, ki za kratek čas ustvari kratke in zelo močne utripe visokih temperatur na majhnih območjih.
Termita-th3 je termat, ki vsebuje 29-odstotno sestavo s maso barijevega nitrata, kar pomaga povečati toplotni učinek, ustvarjati plamen in znatno zmanjšati temperaturo vžiga termita.
Theroots se običajno uporabljajo pri proizvodnji zažigalnih granat in imajo funkcijo uničenja vojaškega oklepa in struktur.
Poleg tega je bil barijev nitrat ena najbolj uporabljenih sestavin pri proizvodnji zažigalnih obtožb, ki jih Britanci uporabljajo v svojih vojnih letalih med drugo svetovno vojno, ki so se oborožile z zažigalnim strelivom, ki je služilo za uničenje sovražnih letal.
Končno ta sol uporablja v proizvodnem procesu barijevega oksida, v industriji termionskih ventilov in, kot že rečeno, pri ustvarjanju pirotehnike, zlasti tistih iz zelenih barv.
Fizikalne in kemijske lastnosti
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Sol je predstavljena kot bela, higroskopska in toaletna trdna snov, ki je v vodi malo topna in popolnoma netopna v alkoholih.
Ima molarno maso 261.337 g/mol, gostoto 3,24 g/cm3 in fuzijska točka 592 ° C. Po dosegu vrelišča se pokvari, kot je bilo rečeno zgoraj. Pri sobni temperaturi ima topnost vode 10,5 g/100 ml.
Šteje se za stabilno, vendar je močno oksidacijsko sredstvo in mora biti oddaljen od gorljivih materialov, da se izognete ognju. Ima občutljivost na vodo in je ne smete mešati s kislinami ali brezvodnimi.
Vam lahko služi: adsorpcijske izoterme: koncept, vrste, primeriV visokih koncentracijah (na primer zabojnike) je treba izolirati od snovi, zaradi katerih lahko reagira, saj lahko nasilno izkorišča.
Kot vsaka druga topna spojina barija je tudi strupena snov za živali in človeška bitja.
Ne smemo ga vdihavati ali zaužiti, saj simptomi zastrupitve (zlasti otrditev obraznih mišic), bruhanje, driska, bolečine v trebuhu, tresenje mišic, tesnoba, šibkost, dihalna stiska, srčna nepravilnost in napadi in napadi.
Smrt se lahko pojavi po zastrupitvi s to snovjo, nekaj ur ali nekaj dni po predstavitvi.
Vdihavanje barijevega nitrata povzroči draženje v dihalni sluznici in pri obeh načinih zastrupitve je treba pripraviti raztopine sulfatnih soli.
V primeru razlitja ga je treba izolirati iz gorljivih snovi in materialov, v primerih požara. Območje je treba preplaviti z vodo, če je ogenj večji.
Reference
- Mabus. (s.F.). Sciencemadness. Pridobljeno iz Sciencemadness.org
- Združene države zažigava bomba Th3-M50A3. (s.F.). Pridobljeno iz streliva.com
- Cameo Chemicals. (s.F.). Pridobljeno od kamemikalij.NOAA.Gov
- Chemspider. (s.F.). Pridobljeno od Chemspider.com

