Molalnost

- 2488
- 302
- Ricky Dach
Kaj je molealnost?
The Molalnost, Označeno s črko M v malih črkah, je izraz, ki se uporablja za opis koncentracije raztopine. Lahko ga opredelimo kot število molov topljenega raztopljenega v 1 kilogramu topila.
Je enak moli topljene (snovi, ki se raztopi), deljeno s topilo kilogrami (snov, ki se uporablja za raztapljanje).

Kjer so topilni moli podani z enačbo:
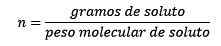
Torej na koncu ostaja enačba mole
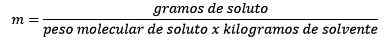
Značilnosti molealnosti
- Molalnost je merilo koncentracije topljenega v raztopini. Se uporablja predvsem, kadar je temperatura zaskrbljujoča.
- Molalnost ni tako pogosta kot njegov protiport, molarnost (moli topila za vsak liter topila), vendar se uporablja v zelo specifičnih izračunih, zlasti glede koligacijskih lastnosti (višina vrelišča, depresija točke zamrzovanja). Ker je prostornina zaradi temperature in tlaka nihanja, se tudi molarnost razlikuje glede na temperaturo in tlak.
- V nekaterih primerih je uporaba teže prednost, ker se masa ne razlikuje glede na okoljske razmere.
- Pomembno je, da se uporabi masa topila in ne masa raztopine.
- Raztopine, označene z moralno koncentracijo. 1,0 m raztopina vsebuje 1 mol topila na kilogram topila.
- Priprava dane moralne rešitve je enostavna, saj zahteva le dobro lestvico. Tako topilo kot topilo se mešata, namesto da se merijo z volumnom.
Lahko vam služi: propanska kislina- Enota SI (mednarodni sistem) za mole je mol/kg ali moli topila na kg topila. Raztopina z moliro 1 mol/kg je pogosto opisana kot "1 mol" ali "1 m".
Vendar pa po sistemu enot SI Nacionalni inštitut za standarde in tehnologijo, ki je pristojnost ZDA pri merjenju.
Razlike in podobnosti med molealnostjo (M) in molarnostjo (M)
Priprava raztopine dane morale pomeni, da tehta tako topilo kot topilo ter pridobi maso.
Toda v primeru molarnosti se meri prostornina raztopine, ki pušča prostor za spreminjanja gostote kot posledica okoljskega in tlačnega stanja.
To pomeni, da gre za predvsem pritisk, medtem ko testo ostane nespremenjeno.
Poleg tega kemične reakcije potekajo v množičnem deležu in ne v prostornini. Da se zanesete na testo, lahko molealnost zlahka postane masno razmerje ali masni delček.
Za vodne raztopine (raztopine, v katerih je voda topila) v bližini temperature okolice, je razlika med moralnimi in molarnimi raztopinami zaničljiva.
To je zato, ker ima okoli okolice temperature gostoto 1 kg / l. To pomeni, da je "z l" molarnosti enaka "kg" molealnosti.
Lahko vam služi: kalcijev smeri: struktura, lastnosti, pridobivanje in uporabeZa topilo, kot je etanol, kjer je gostota 0,789 kg / L, bi bila 1 m rešitev 0,789 m.
Pomemben del zapomnitve razlike je:
Molarnost - m → moli na liter raztopine.
Molalnost - m → moli na kilogram topila.
Primeri molealnosti
Primer 1
Problem: Kakšna je morala rešitve, ki vsebuje 0.086 molov NaCl, raztopljenih v 25,0 g vode?
Odgovor: V tem primeru se uporablja neposredna moralna enačba:
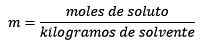
Moli topljene (naCl) = 0,086 mol
Masa (voda) = 25,0 g = 25,0 x 10-3 kg
Zamenjava imate:
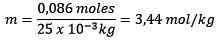
Primer 2
Problem: Kakšna je morala raztopine, če se 124,2 gramov NaOH raztopi v 1,00 litrov vode? (Gostota vode je enaka 1,00 g/ml).
Odgovor: Voda je znana kot univerzalno topilo, gostota pa je običajno dana približno 1,00 grama na mililiter ali kar je enako, 1 kilogram na liter. To olajša pretvorbo iz litrov v kilograme.
V tej težavi bo treba 124,2 grama NaOH pretvoriti v mole (za mole topila) in liter vode bo treba spremeniti v kilograme (s kilogrami topila) z uporabo gostote.
Prvič, tu je Naohina molarna masa:
P.mNa= 22,99 g/mol
P.mTudi= 16 g/mol
P.mH= 1G/mol
P.mNaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
Drugič, Naohovi grami se pretvorijo v mole z uporabo molarnega testa:
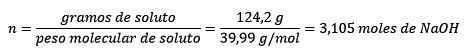
Tretjič, liter vode postane kilogrami z uporabo gostote:
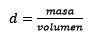
Čiščenje testa ostaja:
Vam lahko služi: zlati oksid (iii) (au2o3): kaj je, struktura, lastnosti, uporabe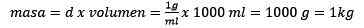
Končno je rešena enačba molelizma:
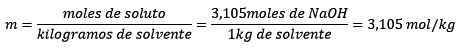
Primer 3
Problem: Kaj je vodna masa vodne raztopine, ki vsebuje 0,52 grama barijevega klorida (Bacl2, PM = 208,23 g/mol), katerih koncentracija je 0,005 mol/kg?
Odgovor: V tem primeru se moralna koncentracija uporablja za določitev količine vode v raztopini.
Najprej dobimo število molov BACL2 V rešitvi:
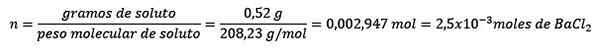
Drugič, kilogrami topila so očiščeni iz enačbe molelizma in razrešeni.
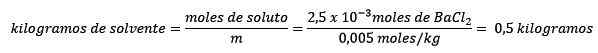
Reference
- Problem za izračun molalnosti. Okreval od Scientetes.org.
- Kaj je primer molalnosti? Okreval od Sokrata.org.
- (S.F.). Morala. Okrevano od brezmejnega.com.

