Kvantni mehanski model atoma

- 2896
- 768
- Dexter Koch
Kakšen je kvantni mehanski model atoma?
On Kvantni mehanski model atoma Predvideva, da to tvori osrednje jedro, ki ga tvorijo protoni in nevtroni. Elektroni negativne obremenitve jedro zavijejo v razpršene regije, znane kot orbitale.
Oblika in podaljšek elektronskih orbitalov določa več magnitud: temeljni potencial in kvantizirana raven energije in kotni zagon elektronov.
 Slika 1. Model helija atoma v skladu s kvantno mehaniko. Sestavljen je iz verjetnostnega oblaka dveh helijevih elektronov, ki obkrožata pozitivno jedro 100 tisočkrat manjše. Vir: Wikimedia Commons.
Slika 1. Model helija atoma v skladu s kvantno mehaniko. Sestavljen je iz verjetnostnega oblaka dveh helijevih elektronov, ki obkrožata pozitivno jedro 100 tisočkrat manjše. Vir: Wikimedia Commons. Glede na kvantno mehaniko imajo elektroni obnašanje dvojnih valovnih delcev, atomska lestvica pa so difuzni in nespecifični. Dimenzije atoma praktično določajo razširitev elektronskih orbitalov, ki obdajajo pozitivno jedro.
Slika 1 prikazuje strukturo helija atoma, ki ima jedro z dvema protonoma in dvema nevtronoma. To jedro je obkroženo z verjetnostnim oblakom obeh elektronov, ki obkrožata jedro, ki je sto tisočkrat manjši. Na naslednji sliki lahko vidite atom helija, s protoni in nevtroni v jedru in elektroni v orbitalih.

Velikost atoma helija je vrstnega reda a angstrom (1 Å), to je 1 x 10^-10 m. Medtem ko je velikost njenega jedra v redu femtometer (1 fm), to je 1 x 10^-15 m.
Kljub temu, da je tako majhna, je 99,9% atomske teže koncentrirano v drobnem jedru. To je zato, ker so protoni in nevtroni 2000 -krat težji od elektronov, ki jih obdajajo.
Vam lahko služi: 31 vrst sile v fiziki in njihove značilnostiAtomska lestvica in kvantno vedenje
Eden od konceptov, ki je najbolj vplival na razvoj atomskega modela, je bil dvojnost Val - delček: Odkritje, da ima vsak materialni predmet povezan val snovi.
Formula, ki omogoča izračun valovne dolžine λ Povezano z materialnim objektom je predlagal Louis de Broglie leta 1924 in je naslednji:
λ = H / (M V)
Kje h Je Planckova konstanta, m testo in v hitrost.
Po načelu De Broglieja ima vsak predmet dvojno vedenje, vendar je odvisno od obsega interakcij, hitrosti in mase, vedenje valov je lahko bolj pomembno kot delček ali obratno.
Elektron je lahek, njegova masa je 9,1 × 10^-31 kg. Tipična hitrost elektrona je 6000 km/s (petdesetkrat manjša od hitrosti svetlobe). Ta hitrost ustreza vrednosti energije v območju več deset elektronov-voltio.
S prejšnjimi podatki in z uporabo formule de Broglie lahko dobite valovno dolžino za elektron:
λ = 6,6 x 10^-34 j s / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Elektron na značilne energije atomskih ravni ima valovno dolžino istega vrstnega reda kot atomska lestvica, tako da ima na tej lestvici ondulacijsko in ne vedenje delcev.
Prvi kvantni modeli
Glede na idejo, da ima elektron atomske lestvice valovito vedenje, so bili razviti prvi atomski modeli, ki temeljijo na kvantnih načelih. Med njimi izstopa Bohrjev atomski model, ki je odlično napovedal spekter emisij vodika, ne pa tudi pri drugih atomih.
Vam lahko služi: napetostno prizadevanje: formula in enačbe, izračun, vajeBOHR-jev model in pozneje model Sommerfelda so bili polklasični modeli. To pomeni, da je bil elektron kot delček, ki je bil podvržen sili elektrostatične privlačnosti jedra, ki kroži okoli njega, ki ga ureja Newtonov drugi zakon.
Poleg klasičnih orbite so ti prvi modeli upoštevali, da ima elektron povezan materialni val. Dovoljene so bile samo orbite, katerih obod je bilo celo število valovnih dolžin, saj so tiste, ki ne izpolnjujejo tega merila.
Takrat se prvič pojavi kvantizacija energije v atomski strukturi.
Beseda kvantni natančno izhaja iz dejstva, da lahko elektron vzame le nekaj diskretnih vrednosti energije znotraj atoma. To sovpada s Planckovo ugotovitvijo, ki je bila sestavljena iz odkritja, da frekvenčno sevanje F Interakcijo s snovjo v energetskih paketih E = H F, kje h Je Planckova konstanta.
Orbitalna oblika in velikost
Radialni obseg orbitala določa Funkcija radijskega valado. Je večja, če energija elektrona raste, to je, če se glavno kvantno število poveča.
Radialna razdalja se ponavadi meri v radijskih sprejemnikih BOHR, ki je za najnižjo vodikovo energijo 5,3 x 10-11 m = 0,53 Å.
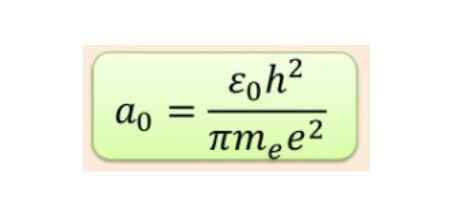 Slika 2. Formula RADIUS BOHR. Vir: f. Zapata.
Slika 2. Formula RADIUS BOHR. Vir: f. Zapata. Toda oblika orbital je določena z vrednostjo kvantnega števila kotnega trenutka. Če je l = 0, imate sferično orbitalo, ki se imenuje S, če je L = 1 poklical lobit orbital str, ki imajo lahko tri orientacije glede na magnetno kvantno številko. Naslednja slika prikazuje obliko orbital.
Vam lahko služi: vektorska velikost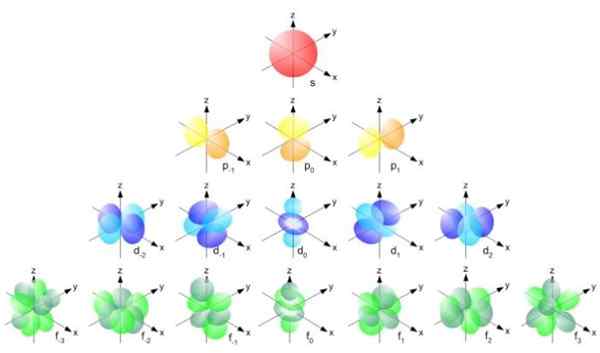 Slika 3. Oblika orbital s, p, d, f. Vir: Ucdavis Chemwiki.
Slika 3. Oblika orbital s, p, d, f. Vir: Ucdavis Chemwiki. Te orbitale so pakirane znotraj drugih glede na energijo elektronov. Na primer, na naslednji sliki prikazuje orbitale v atomu natrija.
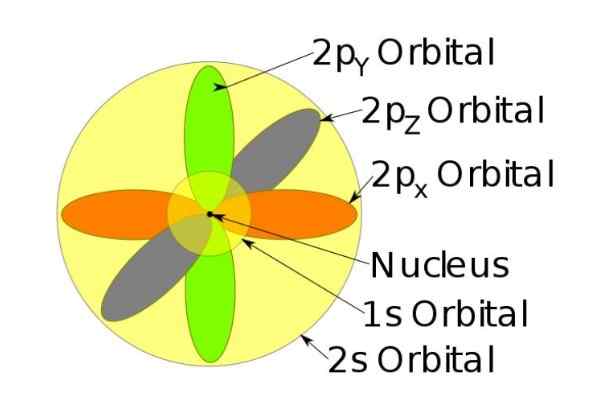 Slika 4. Orbitals 1s, 2s, 2p natrijevega iona, ko je izgubil elektron. Vir: Wikimedia Commons.
Slika 4. Orbitals 1s, 2s, 2p natrijevega iona, ko je izgubil elektron. Vir: Wikimedia Commons. Spin
Kvantni mehanski model Schrödingerjeve enačbe ne vključuje vrtenja elektronov. Toda Pauli se upošteva z načelom izključitve, ki kaže, da lahko orbitale napolnijo do dva elektrona s kvantnimi špirnimi številkami s = +½ in s = -½.
Na primer, natrijev ion ima 10 elektronov, to je, če se sklicujemo na prejšnjo sliko, za vsako orbitalo obstajata dva elektrona.
Če pa gre za nevtralni natrijev atom, obstaja 11 elektronov, od katerih bi zadnji zasedli 3S orbital (ne prikazano na sliki in večji polmer kot 2S). Vrtenje atoma je odločilno v magnetnih značilnostih snovi.
Reference
- Alonso - Finn. Kvantni in statistični temelji. Addison Wesley.
- Eisberg - Resnick. Kvantna fizika. Limusa - Wiley.
- Gashorowicz. Kvantna fizika. John Wiley & Sons.
- Hsc. Tečaj fizike 2. Jacaranda Plus.
- Wikipedija. Schrodingerjev atomski model. Okreval od: Wikipedia.com

