Atomski model zgodovine Rutherforda, poskusi, postulati
- 1253
- 227
- Lee Farrell
On Atomski model Rutherford To je opis atoma, ki ga je ustvaril britanski fizik Ernest Rutherford (1871-1937), ko je leta 1911 odkril atomsko jedro, zahvaljujoč znanim disperzijskim poskusom, ki so poimenovani.
Ideja atoma ("nedeljivo"V grščini) kot najmanjša sestavina materije je bila intelektualna stvaritev, rojena v starodavni Grčiji, približno 300 do.C. Tako kot mnogi drugi grški koncepti je tudi koncept atoma razvit na podlagi logike in argumentacije, ne pa tudi na eksperimentiranju.
 Atomski model Rutherford
Atomski model Rutherford Najpomembnejši atomistični filozofi so bili Demokratit Abdera (460 - 360 pr.n.št. Grki so si zamislili štiri različne vrste atomov, ki so ustrezali štirim elementom, ki so v skladu z njimi tvorili zadevo: zrak, voda, zemlja in ogenj.
Kasneje bi Aristotel dodal peti element: eter, ki je tvoril zvezde, saj so bili ostali štirje elementi čisto kopenski.
Osvajanja Aleksandra Velikega, od katerih je bil Aristotel učitelj, so svoja prepričanja razširili za starodavni svet, od Španije v Indijo in s tem stoletja idejo o atom Ustvaril je svoje mesto v svetu znanosti.
[TOC]
Atom preneha biti nedeljiv
Ideje grških filozofov o strukturi teme so bile vzdrževane kot gotovo sto let, dokler angleški kemik in učitelj z imenom John Dalton (1776-1844) ni objavil rezultatov njegovih poskusov leta 1808.
Dalton se je strinjal, da elementi sestavljajo izjemno majhni delci, imenovani atomi. Toda šlo je dlje z navedbo, da so vsi atomi istega elementa enaki, so enake velikosti, enake mase in enake kemijske lastnosti, zaradi česar ostanejo nespremenjene med kemično reakcijo.
To je prvi atomski model z znanstveno podlago. Tako kot Grki je tudi Dalton atom še naprej smatral kot nedeljivega, saj nima strukture. Vendar ga je Daltonov genij pripeljal do opazovanja enega od velikih načel ohranjanja fizike:
- V kemičnih reakcijah, Atomi niso ustvarjeni niti uničeni, Samo spremenijo svojo distribucijo.
In vzpostavil način, kako so kemične spojine oblikovale "atomi sestavljenih" (molekule):
- Ko se dva ali več atomov različnih elementov združita, da tvorita isto spojino, to vedno storijo v množičnih razmerjih definirano in stalno.
Devetnajsto stoletje je bilo veliko stoletje električne energije in magnetizma. Nekaj let po Daltonovih publikacijah so rezultati nekaterih poskusov med znanstveniki sejali dvome o nedeljivostnosti atoma.
Vam lahko služi: kakšna je kapacitivna reakcija in kako jo izračunati?Crookes Tube
Crookes Tube je bila naprava, ki jo je zasnoval britanski kemik in meteorolog William Crookes (1832-1919). Eksperiment, ki ga je Crookes izvedel leta 1875, je bil sestavljen iz postavitve, znotraj cevi, polne plina pri nizkem tlaku, dveh elektrod, ena imenovana katoda in drugi poklical anoda.
Z vzpostavitvijo potencialne razlike med obema elektrodama je plin zasijal z barvo, ki je bila značilna za uporabljeni plin. To dejstvo je nakazovalo, da je znotraj atoma določena posebna organizacija in da zato ni bila nedeljiva.
Poleg tega je to sevanje ustvarilo šibko fluorescenco v steni steklene cevi pred katodo, ki je rezala senco križne oblike, ki se nahaja v cevi.
To je bilo skrivnostno sevanje, znano kot "katodni žarki", ki je potovalo po ravni črti do anode in je bilo zelo energično, ki je lahko ustvarilo mehanske učinke, in ki je odstopalo proti pozitivno obremenjeni plošči ali tudi z magneti Magneti.
Odkritje elektrona
Sevanja znotraj cevi Crookes ni bilo mogoče zdraviti, saj je imel negativno obremenitev. Joseph John Thomson (1856 - 1940) je odgovor našel leta 1887, ko je našel razmerje med obremenitvijo in maso tega sevanja in ugotovil, da je vedno enako: 1,76 x 10enajst C/kg., Ne glede na plin, zaklenjen v cevi, ali materiala, ki se uporablja za izdelavo katode.
Thomson je poklical te delce Corpuscles. Z merjenjem mase glede na njegov električni naboj je ugotovil, da je vsak truplo veliko manjši od atoma. Zato je predlagal, da bi morali biti del njih in tako odkrili elektron.
Britanski znanstvenik je prvi orisal grafični model atoma z risbo krogle z vstavljenimi točkami, ki je bila po njeni obliki dana pritožba "Buddin of Ciruela". Toda to odkritje je prineslo druga vprašanja:
- Če je zadeva nevtralna in ima elektron negativno obremenitev: v katerem del atoma je pozitivna obremenitev, ki nevtralizira elektrone?
- Če je elektronska masa nižja od mase atoma, iz česa je sestavljen preostanek atoma?
- Zakaj so bili delci pridobljeni vedno elektroni in nikoli druge vrste?
Disperzijski poskusi Rutherford: Atomsko jedro in proton
Do leta 1898 je Rutherford ugotovil dve vrsti sevanja iz urana, ki ga je poklical alfa in beta.
Naravno radioaktivnost je že leta 1896 odkrila Marie Curie. Delci alfa imajo pozitivno obremenitev in so preprosto jedra helija, toda koncept jedra takrat še ni bil znan. Rutherford naj bi ga odkril.
Vam lahko služi: termodinamični sistem: lastnosti, vrste, primeriEden od eksperimentov, ki jih je Rutherford naredil leta 1911 na univerzi v Manchestru, je s pomočjo Hans Geiger sestavljen iz bombardiranja finega zlata z delci alfa, čigar obremenitev je pozitivna. Okoli zlatega lista je postavil fluorescenčni zaslon, ki jim je omogočil vizualizacijo učinkov bombnega napada.
Opazovanja
Rutherford in njeni pomočniki so preučevali vplive na fluorescenčni zaslon, ki so opazili, da:
- Visok odstotek alfa delcev je prečkal list brez opaznega odstopanja.
- Nekateri odstopajo pod precej izrazite kote
- In zelo malo odskočenega nazaj
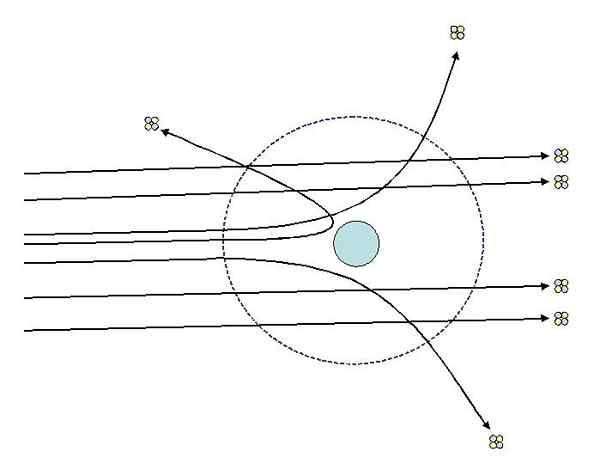 Rutherford Dispersion Experiments. Vir: [cc by-sa 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]].
Rutherford Dispersion Experiments. Vir: [cc by-sa 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Opažanja 2 in 3 sta presenetila preiskovalce in jih privedla do domneve, da bi morala oseba, ki je odgovorna za razpršene žarke.
Sam Rutherford je v zvezi s tem dejal, da je "... kot da ste poskusili pomorski izstrelki 15 -palcev proti listu papirja in izstrelkov se je odbil nazaj in vas udaril". To bi zagotovo lahko razložil model Thompsona.
Rutherford je analiziral njegove rezultate s klasičnega vidika, odkril je obstoj atomskega jedra, kjer je bilo koncentracijo pozitivnega bremena atoma, ki je dalo to nevtralnost.
Rutherford je nadaljeval s svojimi disperzijskimi poskusi. Do leta 1918 so bili novi cilj alfa delcev atomi plinastega dušika.
Na ta način je zaznala vodikova jedra in takoj vedela, da edino mesto, s katerega lahko ta jedra prihajajo iz samega dušika. Kako je bilo mogoče, da so bila vodikova jedra del dušika?
Rutherford je nato predlagal, da bi moral biti vodikovo jedro, element, ki je bil že dodeljen atomski številki 1, temeljni delček. Pokličem jo proton, Grška beseda za označevanje najprej. Tako so odkritja atomskega jedra in protona posledica tega briljantnega neozyreja.
Postulate Rutherfordov atomski model
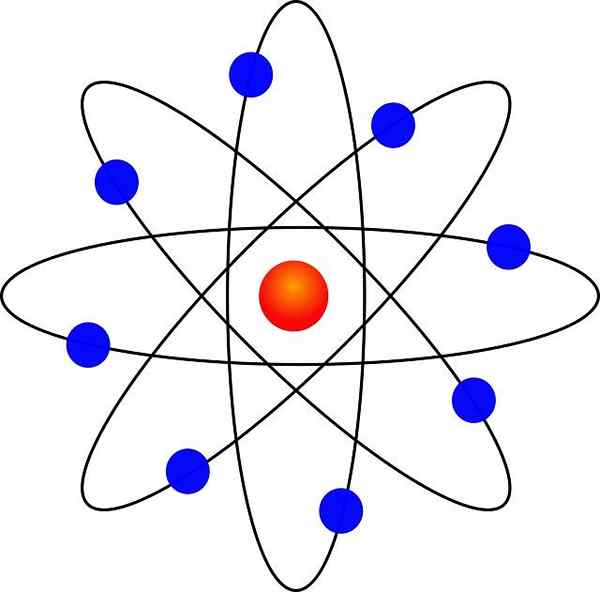
Novi model se je zelo razlikoval od Thompsonove. To so bili njegovi postulati:
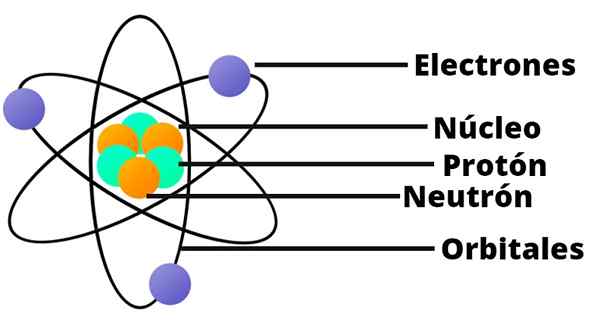
- Atom vsebuje pozitivno obremenjeno jedro, ki kljub zelo majhnemu vsebuje skoraj celotno maso atoma.
- Elektroni krožijo atomsko jedro na veliki razdalji in v krožnih ali eliptičnih orbitah.
- Neto obremenitev atoma je nična, saj naboji elektronov kompenzirajo pozitivno obremenitev v jedru.
Rutherfordovi izračuni so pokazali na sferično jedro in na radio, ki je bil majhen kot 10-petnajst m, ki je vrednost atomskega polmera približno 100.000 krat višje, saj so jedra razmeroma zelo oddaljena drug od drugega: iz vrstnega reda 10-10 m.
 Mladi Ernest Rutherford. Vir: Neznano, objavljeno leta 1939 v Rutherfordu: Biti življenje in pisma RT. Hin. Lord Rutherford, ali. M [cc do 4.0 (https: // creativeCommons.Org/licence/by/4.0)]
Mladi Ernest Rutherford. Vir: Neznano, objavljeno leta 1939 v Rutherfordu: Biti življenje in pisma RT. Hin. Lord Rutherford, ali. M [cc do 4.0 (https: // creativeCommons.Org/licence/by/4.0)] To pojasnjuje, zakaj je večina alfa delcev prekrižala list brez nevšečnosti ali komajda doživela zelo majhen odklon.
Rutherfordov atom bi bil viden na vsakdanjih predmetih, sestavljen iz jedra velikosti baseballa, atomski polmer. Zato lahko atom obravnavamo skoraj vse kot prazen prostor.
Zahvaljujoč svoji podobnosti z miniaturnim sončnim sistemom je bil znan kot "planetarni model atoma". Sila elektrostatične privlačnosti med jedrom in elektroni bi bila analogna gravitacijski privlačnosti med Soncem in planeti.
Omejitve
Vendar pa so se glede nekaterih opazovanih dejstev pojavile določena nesoglasja:
- Če je ideja, da je elektronska orbita okoli jedra sprejeta, zgodi, da mora elektron nenehno oddajati sevanje, dokler ne trči v. To na srečo ni tisto, kar se v resnici zgodi.
- Poleg tega atom ob določenih primerih oddaja določene frekvence elektromagnetnega sevanja, ko obstajajo prehodi med večjo energijo na eno z manj energije, in samo te frekvence, ne druge. Kako razložiti dejstvo, da je energija kvantizirana?
Kljub tem omejitvam in da je danes veliko bolj izpopolnjenih modelov in po opazovanih dejstvih je Rutherfordov atomski model še vedno koristen, da ima študent prvi uspešen pristop atoma in njegovih sestavnih delcev.
V tem modelu atoma se ne zdi nevtron, še ena sestavina jedra, ki je bila odkrita šele leta 1932.
Kmalu po tem, ko je Rutherford predlagal svoj planetarni model, bi ga danski fizik Niels Bohr leta 1913 spremenil, da bi razložil, zakaj atom ni uničen, in še vedno smo tu, da bi povedali to zgodbo.
Zanimivi članki
Schrödinger Atomski model.
Broglie Atomski model.
Chadwick Atomski model.
Heisenberg Atomski model.
Perrin atomski model.
Thomson Atomski model.
Atomski model Dirac Jordan.
Atomski model Demokrita.
Atomski model Bohr.
Dalton Atomski model.
Reference
- Rex, a. 2011. Osnove fizike. Pearson. 618-621.
- Zapata, f. 2007. Razredne opombe za radiobiologijo in radiološko zaščitno stol. Javnozdravstvena šola Centralne univerze v Venezueli.

