Značilnosti ionske povezave, kako oblike in primeri

- 1967
- 246
- Cary Goyette
On Ionska povezava To je vrsta kemične vezi, pri kateri obstaja elektrostatična privlačnost med ioni z nasprotno obremenitvijo. To pomeni, da pozitivno obremenjeni ion tvori povezavo z ionom, ki je negativno naložen, in prenaša elektrone iz enega atoma v drugega.
Ta vrsta kemične vezi se pojavi, ko se valenčni elektroni enega atoma trajno prenašajo na drugega. Atom, ki izgubi elektrone, postane kation (pozitivno naložen), tisti, ki pridobi elektrone, postane anion (negativno naložen).
 Primer ionske vezi: natrijev fluorid. Natrij izgubi elektron Valencia in ga daje fluoridu. Wdcf [cc by-s (https: // creativeCommons.Org/licence/by-sa/3.0)]
Primer ionske vezi: natrijev fluorid. Natrij izgubi elektron Valencia in ga daje fluoridu. Wdcf [cc by-s (https: // creativeCommons.Org/licence/by-sa/3.0)] [TOC]
Koncept ionske povezave
Ionska vez je v tem, da električno nabiti delci, imenovani ioni, medsebojno vplivajo na ionske trdne snovi in tekočine. Ta povezava je produkt elektrostatičnih interakcij med sto milijoni ionov in ni omejena le na nekaj; to pomeni, da presega privlačnost med pozitivnim bremenom do negativne obremenitve.
Razmislite na primer ionski sestavljeni natrijev klorid, NaCl, najbolje znan kot namizna sol. V NaCl prevladuje ionska vez, tako da je sestavljena iz Na ionov+ in Cl-. Na+ Je pozitiven ion ali kation, medtem ko Cl- (Klorid) je negativni ion ali anion.
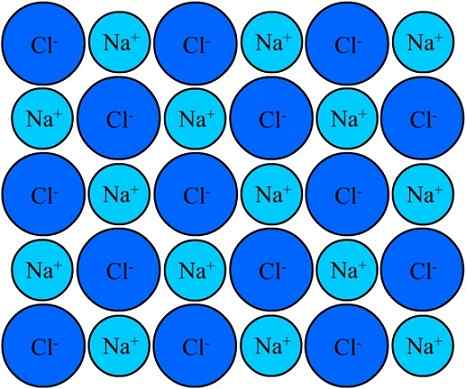 Na+ in cl-ioni v natrijevem kloridu ostanejo združeni, zahvaljujoč joonski vezi. Vir: Eyal Bairey prek Wikipedije.
Na+ in cl-ioni v natrijevem kloridu ostanejo združeni, zahvaljujoč joonski vezi. Vir: Eyal Bairey prek Wikipedije. Oba na+ Kot Cl- Privabljajo jih, da so nasprotni električni tovori. Razdalje med temi ioni omogočajo, da se približajo drugim, tako da se pojavijo pari in pari NaCl. Na kationi+ Med seboj se bodo odbijali, ker so enake obremenitve, in enako se dogaja med seboj s cl anioni-.
Prihaja čas, ko milijoni Na ionov+ in Cl- Uspejo poenotiti, kohezivno, da izvirajo čim bolj stabilno strukturo; Uredi z ionsko povezavo (vrhunska slika). Na kationi+ So manjši od anionov- Zaradi vse večje učinkovite jedrske sile svojega jedra na zunanjih elektroni.
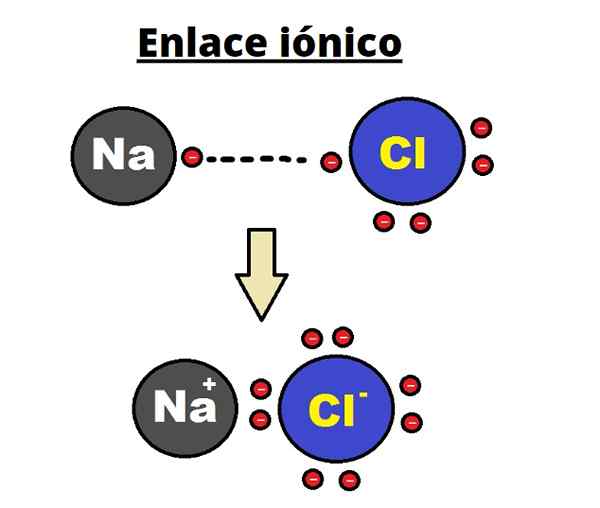 NaCl ionska povezava. Rhannosh/cc by-sa (https: // createCommons.Org/licence/by-sa/3.0
NaCl ionska povezava. Rhannosh/cc by-sa (https: // createCommons.Org/licence/by-sa/3.0 Za ionsko vez je značilno vzpostavitev urejenih struktur, kjer je razdalja med ioni (NA+ in Cl- V primeru NaCl) je majhna v primerjavi z drugimi trdnimi snovmi. Govori o ionski kristalni strukturi.
Kako je ionska povezava?
Ionska vez se zgodi le, če pride do porazdelitve elektronov, tako da se pojavijo obremenitve z ioni. Ta vrsta povezave se nikoli ne more pojaviti med nevtralnimi delci. Nujno morajo biti kationi in anioni. Toda od kod prihajajo?
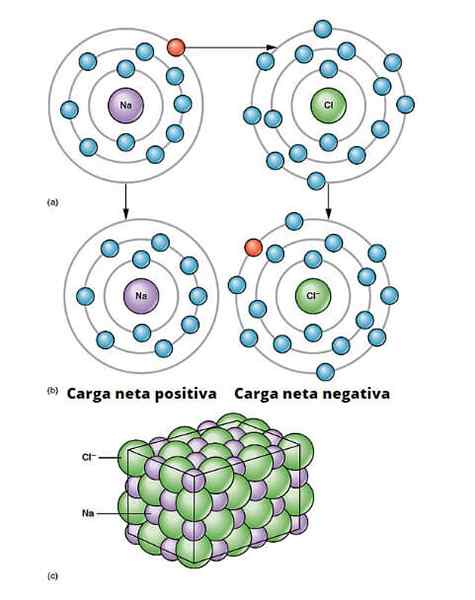 Ilustracija ionske povezave. a) Natrij ima negativno neto obremenitev. b) natrij daje elektron kloru. Natrij je s pozitivno neto obremenitvijo in klor z negativno neto obremenitvijo, ki ustvarja ionsko vez. Ta vrsta povezave med milijoni atomov NA in CL povzroča fizično sol. OpenX College/CC by (https: // creativeCommons.Org/licence/by/3.0
Ilustracija ionske povezave. a) Natrij ima negativno neto obremenitev. b) natrij daje elektron kloru. Natrij je s pozitivno neto obremenitvijo in klor z negativno neto obremenitvijo, ki ustvarja ionsko vez. Ta vrsta povezave med milijoni atomov NA in CL povzroča fizično sol. OpenX College/CC by (https: // creativeCommons.Org/licence/by/3.0 Obstaja veliko načinov, na katere izvirajo ioni, vendar v bistvu mnogi temeljijo na reakciji oksidacije. Večina anorganskih ionskih spojin je sestavljena iz kovinskega elementa z nemetalnim elementom (tistih v bloku str periodične tabele).
Kovina mora oksidirati, izgubiti elektrone, se preoblikovati v kation. Po drugi strani se nemetalni element zmanjša, pridobi te elektrone in postane anion. Naslednja slika prikazuje to točko za nastanek NaCl iz atomov natrija in klora:
Vam lahko služi: arsenova kislina (H3SO4): lastnosti, tveganja in uporabe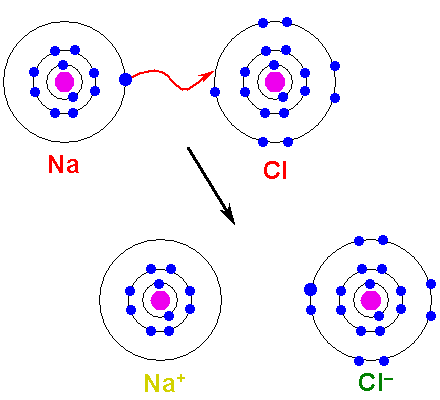 Oblikovanje ionske povezave. Vir: Shafei v arabski Wikipediji / javna domena
Oblikovanje ionske povezave. Vir: Shafei v arabski Wikipediji / javna domena Atom NA donira enega od svojih elektronov Valencia CL. Ko pride do te porazdelitve elektronov, se oblikujejo ioni NA+ in Cl-, ki začnejo privabljati takoj in elektrostatično.
Zato se reče, da Na+ in Cl- Nimajo nobenega para elektronov, za razliko od tistega, kar bi lahko pričakovali za hipotetično kovalentno vez NA-CL.
Lastnosti ionskih povezav
Ionska vez ni usmerjena, to je, da njegova moč ni prisotna v eni smeri, ampak jo širi prostor na podlagi razdalj, ki ločujejo ione. To dejstvo je pomembno, saj pomeni, da so ioni močno združeni, kar pojasnjuje več fizikalnih lastnosti ionskih trdnih snovi.
Tališče
Ionska vez je odgovorna za sol do temperature 801 ° C. Ta temperatura je v primerjavi z fuzijskimi točkami več kovin znatno visoka.
To je zato, ker mora NACL absorbirati dovolj toplote, da se njeni ioni začnejo prosto tekati zunaj svojih kristalov; to pomeni, da je treba atrakcije med NA premagati+ in Cl-.
Vrelišče
Fuzijske in vrelišča ionskih spojin so še posebej visoki produkt njihovih močnih elektrostatičnih interakcij: njihova ionska vez. Ker pa ta povezava vključuje veliko ionov, se to vedenje običajno dodeli medmolekularne sile in ne pravilno za ionsko vez.
V primeru soli, ko se NaCl stopi, dobimo tekočino, sestavljeno iz istih začetnih ionov; Šele zdaj se premikajo z večjo svobodo. Ionska povezava je še vedno prisotna. Na ioni+ in Cl- Srečajo se na površini tekočine, da ustvarijo veliko površinsko napetost, ki preprečuje, da bi ioni pobegnili iz plinske faze.
Zato mora staljena sol še povečati svojo temperaturo, da zavre. NaCl -jeva vrelišče je 1465 ° C. Pri tej temperaturi toplota presega znamenitosti med+ in Cl- V tekočini se tako naCl hlapi začnejo oblikovati s tlakom, ki je enak atmosferski.
Elektronegativnost
Prej je bilo rečeno, da se ionska vez oblikuje med kovinskim in nemetalnim elementom. Če povzamemo račune: med kovino in ne -kometalom. Običajno je to v smislu anorganskih ionskih spojin; Predvsem tisti iz binarne vrste, kot je NaCl.
Za porazdelitev elektronov (NA+Cl-) in ne delitev (NA-CL), med obema atomama mora biti velika razlika v elektronegativnosti. V nasprotnem primeru med njima ne bi bilo nobene ionske povezave. Mogoče pristop NA in Cl, interakcija, vendar takoj CL, za svojo večjo elektronegativnost, "ugrabi" elektron na NA.
Vendar ta scenarij velja samo za binarne spojine, MX, kot je NaCl. Za druge soli ali ionske spojine so njihovi procesi treninga bolj zapleteni in jih ni mogoče obravnavati z zgolj atomske ali molekularne perspektive.
Lahko vam služi: AlquinosFantje
Ni različnih vrst ionskih vezi, saj je elektrostatični pojav čisto fizičen, spreminja se le način, kako se ioni medsebojno medsebojno medsebojno, ali število atomov, ki jih imajo; torej če so monoatomski ali poliatomski ioni. Tudi vsak element ali spojina povzroči značilen ion, ki določa naravo spojine.
V razdelku Primeri se bo ta točka poglobila in razvidno bo, da je ionska povezava v bistvu enaka v vseh spojinah. Kadar to ni izpolnjeno, se reče, da ima ionska vez določen kovalenten značaj, kar je primer številnih prehodnih kovin, kjer so anioni usklajeni s kationi; Na primer FECL3 (Vera3+-Cl-).
Primeri ionskih povezav
Spodaj bo navedenih več ionskih spojin, izpostavljeni pa bodo njihovi ioni in deleži:
- Magnezijev klorid
MGCL2, (Mg2+Cl-), V deležu 1: 2 (mg2+: 2 Cl-)
- Kalijev fluorid
Kf, (k+F-), V deležu 1: 1 (k+: F-)
- Natrijev sulfid
Na2S, (Na+S2-), V deležu 2: 1 (2+: S2-)
- Lito hidroksid
Lioh, (li+Oh-), V deležu 1: 1 (li+: Oh-)
- Kalcijev fluorid
Caf2, (Ac2+F-), V deležu 1: 2 (CA2+: 2f-)
- Natrijev karbonat
Na2Co3, (Na+Co32-), V deležu 2: 1 (2+: Co32-)
- Kalcijev karbonat
Tat3, (Ac2+Co32-), V deležu 1: 1 (CA2+: Co32-)
- Kalijev permanganat
Kmno4, (K+Mne4-), V deležu 1: 1 (k+: Mn4-)
- Bakreni sulfat
Cuso4, (Cu2+SW42-), V deležu 1: 1 (Cu2+: Torej42-)
- Barijev hidroksid
Ba (oh)2, (Ba2+Oh-), V deležu 1: 2 (ba2+: Oh-)
- Aluminijev bromid
Alb3, (Do3+Br-), v deležu 1: 3 (v3+: 3BR-)
- Železov oksid (iii)
Vera2Tudi3, (Vera3+Tudi2-), V deležu 2: 3 (2fe3+: 32-)
- Stroncijev oksid
Sro, (sr2+Tudi2-), V deležu 1: 1 (SR2+: Bodisi2-)
- Srebrni klorid
AGCL, (AG+Cl-), V deležu 1: 1 (Ag+: Cl-)
- Drugi
-Pogl3Cona, (izberite3COO-Na+), V deležu 1: 1 (CHO3COO-: Na+)
- Nh4I, (nh4+Yo-), V deležu 1: 1 (NH4+: Yo-)
Vsaka od teh spojin predstavlja ionsko vez, kjer milijone ionov, ki ustrezajo njihovim kemičnim formulam. Večja kot je velikost njegovih ionskih obremenitev, bolj intenzivne bodo znamenitosti in elektrostatične odbojnosti.
Zato je ionska vez močnejša, večja so naboji ionov, ki sestavljajo spojino.
Vam lahko služi: alkeniRešene vaje
Nekatere vaje, ki postavljajo osnovno znanje o ionski povezavi, bodo rešene spodaj.
- Vaja 1
Katera od naslednjih spojin je ionska? Možnosti so: hf, h2Ali, ne, h2S, nh3 in MGO.
Ionska spojina mora imeti ionsko vez po definiciji. Večja kot je razlika v elektronegativnosti med njenimi sestavnimi elementi, večji je ionski značaj omenjene povezave.
Zato se možnosti, ki nimajo kovinskega elementa, načeloma zavržejo: hf, h2Ali, h2S in nh3. Vse te spojine tvorijo samo nemetalni elementi. Kation nh4+ Je izjema od tega pravila, ker nima kovine.
Preostale možnosti sta NAH in MGO, ki imata kovine NA in MG, združene z nemetalnimi elementi. Ne (Na+H-) in MGO (Mg2+Tudi2-) So ionske spojine.
- Vaja 2
Razmislite o naslednji hipotetični spojini: AG (NH4)2Co3Yo. Kakšni so vaši ioni in v kakšnem deležu so v trdni snovi?
Razgradnja spojine na njihovih ionov, ki jih imamo: AG+, Nh4+, Co32- in jaz-. Te se združujejo elektrostatično po deležu 1: 2: 1: 1 (Ag+: 2nh4+: Co32-: Yo-). Pomeni, da količina kationov NH4+ Dvojno je, da za Ag ione+, Co32- in jaz-.
- Vaja 3
Katera od naslednjih spojin bi načeloma pričakovali, da je imela najmočnejša ionska povezava? Možnosti so: KBR, CAS, NA2SW4, Cuo, Alpo4 in pb3Str4.
KBR je sestavljen iz K ionov+ in br-, Z velikostjo obremenitve. Potem ima CA CA ione2+ in s2-, Z dvojnimi obremenitvami, zato bi lahko mislili, da je ionska povezava v CAS močnejša kot v KBR; In tudi močnejši kot v NA2SW4, Ker je slednji sestavljen iz Na ionov+ In tako42-.
Tako CAS kot CUO imata lahko enako močno ionsko povezavo, saj oba vsebujeta ione z obremenitvami z dvojno velikostjo. Potem imamo alpo4, z ioni al3+ in po43-. Ti ioni imajo trojne obremenitve, zato je ionska povezava v ALPO4 Moral bi biti močnejši kot pri vseh zgornjih možnostih.
In končno imamo zmagovalca PB3Str4, No, če domnevamo, da ga tvorijo ioni, postanejo PB4+ In p3-. Njihove obremenitve imajo največje velikosti; In zato PB3Str4 To je spojina, ki ima verjetno najmočnejšo ionsko vez.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Ionsko vezanje. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (11. februar 2020). Ionske in kovalentne vezi - razumejte razliko. Okreval od: Thoughtco.com
- Uredniki Enyclopeedia Britannica. (31. januarja 2020). Ionska vez. Encyclopædia Britannica. Okrevano od: Britannica.com
- Slovar Chemicool. (2017). Opredelitev ionske vezi. Okrevano od: Chemicool.com
- « Granrataria ravnotežje, deli in kako ga uporabljati
- Atomski model zgodovine Rutherforda, poskusi, postulati »

