Broglie Atomski model

- 5005
- 485
- Ricky Dach
On Broglie Atomski model Predlagal ga je francoski fizik Louis Broglie leta 1924. Broglie je v svoji doktorski disertaciji dejal, da je dvojnost elektronov valovnih delcev, ki je postavila temelje valovite mehanike. Broglie je objavil pomembne teoretične ugotovitve o naravi Wave-Corpusculus.
Pozneje sta Brogliejeva izjave eksperimentalno pokazala znanstvenika Clinton Davisson in Lester Germer, leta 1927. Valovna teorija Broglie Electrons temelji na Einsteinovem predlogu o valovitih lastnostih svetlobe v kratkih valovnih dolžinah.
 Louis Broglie
Louis Broglie Broglie je napovedal možnost, da ima Matter vedenje, podobno kot pri svetlobi, in predlagal podobne lastnosti v subatomskih delcih, kot so elektroni.
Električne in orbitne obremenitve omejujejo amplitudo, dolžino in frekvenco vala, ki jih opisujejo elektroni. Broglie je razložil gibanje elektronov okoli atomskega jedra.
[TOC]
Značilnosti atomskega modela Broglie
Da bi razvili svoj predlog, se je Broglie začel iz načela, da imajo elektroni dvojno naravo med valom in delcem, podobno svetlobi.
V tem smislu je Broglie naredila podobno med obema pojavoma in na podlagi enačb, ki jih je razvil Einstein za preučevanje valovilne narave svetlobe, je dejal naslednje:
- Skupna energija fotona in posledično skupna energija elektrona izhaja iz produkta valovne frekvence in konstante deske (6.62606957 (29) × 10 -3. 4 Jules x sekunde), kot je podrobno opisano v naslednjem izrazu:

V tem izrazu:
E = elektronska energija.
H = konstanta plošče.
F = valovna frekvenca.
- Linearni trenutek fotona in zato je elektrona obratno sorazmeren dolžini vala in obe velikosti sta povezani s konstanto plošče:
Vam lahko služi: reverzna osmoza: kako deluje, za kaj je, primeri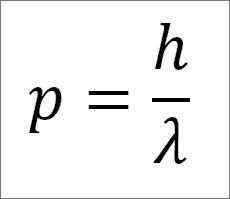
V tem izrazu:
P = linearni trenutek elektrona.
H = konstanta plošče.
λ = valovna dolžina.
- Linearni trenutek je produkt mase delca zaradi hitrosti, ki jo ima delček med premikom.
Če je prejšnji matematični izraz prestrukturiran glede na valovno dolžino, je naslednje:
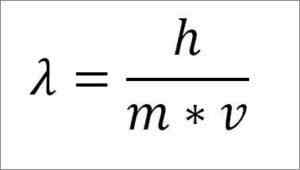
V tem izrazu:
λ = valovna dolžina.
H = konstanta plošče.
M = elektronska masa.
V = hitrost elektrona.
Ker ima H, konstanta plošče, majhno vrednost, je tudi valovna dolžina λ. Posledično je mogoče trditi, da so lastnosti valov elektrona predstavljene le na atomski in subatomski ravni.
- Broglie temelji tudi na postulacijah atomskega modela Bohr. Glede na slednje so orbite elektronov omejene in so lahko le večkratne številke. Tako:
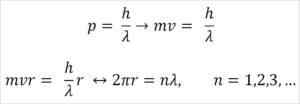
Kje:
λ = valovna dolžina.
H = konstanta plošče.
M = elektronska masa.
V = hitrost elektrona.
R = polmer orbite.
n = celotna številka.
Po Bohrjevem atomskem modelu, ki ga je Broglie sprejel kot bazo, če se elektroni obnašajo kot stacionarni valovi, so edine dovoljene orbite tisti, katerih polmer je enak celotnemu večkratniku valovne dolžine λ.
Zato niso vse orbite v skladu s potrebnimi parametri, da se elektron mobilizira s temi. Tukaj je razlog, zakaj se elektroni lahko premikajo le v določenih orbitah.
Valovna teorija Brogliejevih elektronov je utemeljila uspeh Bohrovega atomskega modela, da bi razložila edinstveno vedenje elektronov atoma vodika.
Vam lahko postreže: suha baterijaPodobno je dal tudi luči, zakaj se ta model ni prilagodil bolj zapletenim sistemom, to je atomov z več kot enim elektronom.
Eksperiment Davisson in Germer
Eksperimentalno preverjanje atomskega modela Broglie je potekal 3 leta pozneje iz njene objave, leta 1927.
Ugledni ameriški fiziki Clinton J. Davisson in Lester Germer sta eksperimentalno potrdila teorijo o valovanju mehanike.
Davisson in Germer sta opravila disperzijske teste elektronskega žarka skozi nikeljni kristal in opazila pojav difrakcije skozi kovinsko okolje.
Izvedeni poskus je bil sestavljen iz izvedbe naslednjega postopka:
- Najprej je bil nameščen sklop z elektronskim žarek, ki je imel znano začetno energijo.
- Za pospešitev gibanja elektronov je bil nameščen napetostni vir, ki spodbuja potencialno razliko.
- Pretok elektronskega žarka do kovinskega stekla je bil usmerjen; V tem primeru nikelj.
- Merjeno je bilo število elektronov, ki so udarili v nikelj steklo.
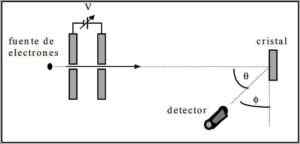
Na koncu eksperimentiranja sta Davisson in Germer zaznala, da so se elektroni razpršili v različnih smereh.
Pri ponovitvi poskusa z uporabo kovinskih kristalov z različnimi orientacijami so znanstveniki zaznali naslednje:
- Disperzija elektronskega žarka skozi kovinsko steklo je bila primerljiva s pojavom motenj in difrakcije svetlobnih žarkov.
- Odraz elektronov na udarnem steklu je opisal smer, ki bi jo teoretično morala opisati v skladu z Broglie Electron Waveom Teorijo.
Skratka, eksperiment Davisson in Germer sta eksperimentalno dokazala naravo dvojnih valovnih delcev elektronov.
Vam lahko služi: Polarna kovalentna povezava: značilnosti in primeriOmejitve
Atomski model Broglie ne napoveduje natančne lokacije elektrona na orbiti, v kateri se premika.
V tem modelu se elektroni dojemajo kot valovi, ki se mobilizirajo po orbiti brez določene lokacije, ki uvaja koncept elektronske orbitala.

Poleg tega Brogliejev atomski model, analogen Schrödingerjevi modelu, ne upošteva vrtenja elektronov na isti osi (prepir).
Z ignoriranjem intrinzičnega kotnega zagona elektronov se prostorske variacije teh subatomskih delcev pustijo na strani.
V istem vrstnem redu idej ta model tudi ne upošteva sprememb v vedenju hitrih elektronov kot rezultat relativističnih učinkov.
Zanimivi članki
Schrödinger Atomski model.
Chadwick Atomski model.
Heisenberg Atomski model.
Perrin atomski model.
Thomson Atomski model.
Dalton Atomski model.
Atomski model Dirac Jordan.
Atomski model Demokrita.
Atomski model Leucipo.
Atomski model Bohr.
Trenutni atomski model.
Reference
- Bohrjeva kvantna teorija in de broglie valovi.F.). Okreval od: NE.Phys.Kyushu-u.AC.J
- Louis de Broglie - biografski (1929). © Nobelova fundacija. Okreval od: NobelPrize.org
- Louis-victor de Broglie (s.F.). Pridobljeno od: chemed.Kem.Purdue.Edu
- Lovett, b. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Okrevano od: Britannica.com
- De broglie atomski model. Nacionalna univerza za izobraževanje na daljavo. Španija. Okreval od: OCW.Innova.Need.je
- Louis de Broglie.F.). Okreval od: Hiru.Eus
- Von Pamel, ali., In Marchisio, s. (s.F.). Kvantna mehanika. Nacionalna univerza v Rosariu. Okreval od: fceia.a r.Edu.ar

