Trenutni atomski model

- 2938
- 381
- Percy Feeney
Kakšen je trenutni atomski model?
On Trenutni atomski model To je tisti, ki temelji na kvantni mehaniki, zlasti v Schrödingerjevi enačbi, po načelu izključitve Paulija in lastnosti elektrona, imenovanega prepir tudi ESPIN.
Je model največjega sprejemanja in uporabe pri preučevanju strukture atomov, molekul in v kemični reaktivnosti elementov zaradi natančnosti njihovih napovedi in njihove relativne preprostosti.
 Slika 1. Vodikov atom v vzbujenem stanju in njegovih atomskih številkah: energija n = 4, kotni zagon l = 3 in magnetni moment M = 1. Vir: Wikimedia Commons.
Slika 1. Vodikov atom v vzbujenem stanju in njegovih atomskih številkah: energija n = 4, kotni zagon l = 3 in magnetni moment M = 1. Vir: Wikimedia Commons. Ta model je evolucija več prejšnjih atomskih modelov, kot sta model Rutherford in Bohr - Sommerfeld, ki veljajo za klasične ali polklasične modele.
Trenutno obstajajo teoretično popolnejši modeli kot Schrödingerjev tipizični model, kot je model Dirac-Jordan, ki vključuje posebno relativnost in temelji na enačbi Dirac Wave. V tej enačbi se lastnost elektronov, omenjenih na začetku, pojavlja naravno.
Obstajajo tudi modeli, ki temeljijo na kvantni teoriji polja, ki se uporabljajo v visokoenergetski fiziki. Ti modeli so odlični pri napovedovanju ustvarjanja in uničenja temeljnih delcev, cilj tega fizikalnega področja.
Omeniti velja, da se najbolj izpopolnjene teorije zbližajo na enake rezultate kot Schrödingerjeve enačbe, zlasti za svetlobne atome.
Trenutne značilnosti atomskega modela
V viziji trenutnega atoma, ki temelji na nerelativističnem kvantu, v slogu planetarnih sistemov ni koncepta elektronskih orbite.
Vendar je najbolj razširjena podoba atoma še vedno v pozitivnem osrednjem jedru in nekaterih negativnih električnih nabojih (elektronov), ki se v popolnoma definiranih orbitah obrnejo okoli osrednjega jedra. Toda kljub svojim koreninam ne ustreza več trenutnemu atomskemu modelu.
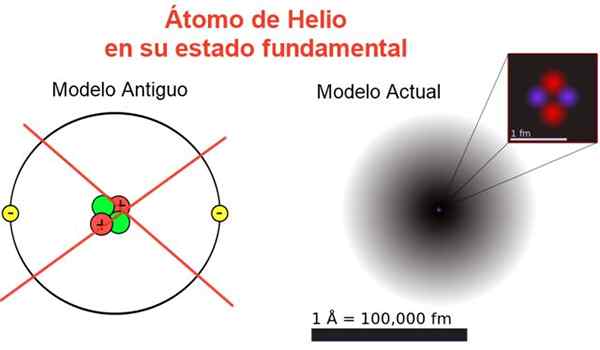 Slika 2. Klasična in trenutna podoba atoma helija v svojem temeljnem stanju. V trenutnem modelu sta dva elektrona helija atoma razpršena v regiji, imenovani orbital. Vir: Wikimedia Commons, vaša lastna kompozicija.
Slika 2. Klasična in trenutna podoba atoma helija v svojem temeljnem stanju. V trenutnem modelu sta dva elektrona helija atoma razpršena v regiji, imenovani orbital. Vir: Wikimedia Commons, vaša lastna kompozicija. Slika 2 prikazuje staro sliko in trenutno sliko atoma helija v manjšem energijskem stanju (stopnja n = 1 in l = 0).
Lahko vam služi: povprečni pospešek: kako se izračuna in rešiKlasična slika je koristna za to, da jedro vsebuje dva protona in dva nevtrona. Zagotavljanje nevtralnosti atoma obstajata dva elektrona, ki zasedata isto energijsko raven.
Od ostalega je slika, ki je oddaljena od resničnosti, saj lestvica jedra sploh ne ustreza atomu: Jedro je 1/100000 -krat večja od atoma, toda tam je koncentrirana atomska masa.
Dvojnost ONDA - delček
Klasična mehanika ugotovi, da ima vsak materialni delček povezan val, imenovan Valovna funkcija. To je znano Dvojnost delcev od Louis de Broglie.
V trenutnem atomskem modelu je obnašanje elektrona na lestvici atomov vidno valovito, medtem ko na makroskopski ravni, kot so elektroni, ki se premikajo v katodnih cevi starih televizorjev.
Po drugi strani pa se s fotoni zgodi nasprotno, v večini optičnih pojavov (na makroskopski ravni) imajo bistveno valovito vedenje. In ko sodelujejo z zadevami snovi, imajo vedenje delcev.
Zaradi tega se elektroni okoli jedra raztresejo na območja, imenovana atomske orbitale, katerih oblika in podaljšek bosta odvisna od energijske ravni elektronov in kotnega zagona.
Tako energija kot kotni zagon elektrona okoli jedra imata določene dovoljene vrednosti, zato se reče kvantizirano.
Schrödingerjeva valovna enačba napoveduje, katere vrednosti energije in kotni zagon so dovoljene, pa tudi valovna funkcija, povezana z vsako energijo in stopnjo zagona.
Matematični kvadrat valovne funkcije določa orbitale, to je območja okoli jedra, kjer je mogoče najti elektrone, bolj verjetno.
Velikost atoma
Da bi imeli obsežno sliko trenutnega atomskega modela, si predstavljajmo, da ima atom premer, kakršen je v nogometnem polju. Jedro bi bilo kot mravlja na sredini polja, a presenetljivo z 99,9% atomske mase.
Po drugi strani bi bili elektroni kot razpršeni igralci na celotnem igrišču, z večjo verjetnostjo, da jih bodo našli v sredini vezista.
Vam lahko služi: kategorična spremenljivka: značilnosti in primeriObstaja nekaj poravnav ali dovoljenih načinov za zasedbo polja, ki so odvisni od energije igralcev (elektronov) in količine "obračanja" ali vrtenja okoli središča.
Trenutni atomski model postulira
1.- Za elektron je značilna masa m, ki je zavrtena s In ker je osnovni delček nosilca negativne obremenitve (-e).
2.- Elektroni imajo dvojno, valovno v obliki vedenja, vendar je odvisno od njihove energije in obsega pojava lahko bolj prevladujoč od drugega.
3.- Elektroni obdajajo pozitivno atomsko jedro, tako da zagotavljajo električno nevtralnost atoma. Zato je količina elektronov enaka količina protonov; To je atomska številka, ki daje kemijske in fizikalne značilnosti vsakega elementa.
4.- Interakcija med elektroni in jedrom modelira potencialni V (r) Coulombov elektrostatični, ki je vključen v izraz potencialna energija v Hamiltonovem operaterju.
5.- Izraz kinetične energije v Hamiltonovi operaterju je operater, ki je zgrajen iz linearnega operaterja zagona, ki je enak:
str = - i ħ ∂ /∂r
Kjer je ħ konstanta Plancka, razdeljena z 2π.
6.- Hamiltonski operater h = (P⋅p)/2M - E V (r) delujejo na funkciji elektronskega vala ψ (r).
7.- Ko se iščejo stacionarne rešitve funkcije elektronskega vala, se uporablja neodvisna Schrödingerjeva enačba časa:
H ψ (r) = E ψ (r)
Kjer E predstavlja skupno energijo elektrona.
8.- V atomih z več elektroni se interakcija med njimi ne upošteva.
9.- Ko gre za atome številnih elektronov, orbitale najbolj zunanjih elektronov modelirajo potencial zaščitenega jedra z največ notranjim elektronom, ki je znan kot Debye potencial.
10.- Enačba (7) ima rešitev za nekatere diskretne vrednosti energije, tako da slavne osebnosti Koliko od Plancka, Seveda se pojavljajo iz Schrödingerjevih rešitev enačb.
Lahko vam služi: stacionarne valove: formule, značilnosti, vrste, primerienajst.- Za vsako diskretno vrednost obstaja valovna funkcija. Toda nekatere rešitve so degenerirane, odvisno od vrednosti kotnega zagona l.
12.- Valovna funkcija je produkt radialne funkcije, azimutalne funkcije in polarne funkcije.
13.- Ta valovna funkcija določa dovoljena območja za elektron. Kvadrat valovne funkcije je gostota verjetnosti najti elektron v določenem položaju, ki ga vidimo iz središča atomskega jedra.
14.- Spin se ne pojavlja v Schrödingerjevi enačbi, ampak je vključen v atomski model z načelom Pauli:
Elektron je fermion z dvema možnima stanjem spin +½ in -½.
Torej lahko isto stanje, za katerega so značilne kvantne številke n, l, m Schrödingerjeve enačbe, lahko zasedeta največ 2 elektrona z nasprotnimi nasprotji nasprotovanja. Na ta način Espin postane četrta kvantna številka.
Vplivni znanstveniki v trenutnem atomskem modelu
Zdi se neverjetno, toda večina fizikov, ki so prispevali k trenutnemu atomskemu modelu, se pojavi na isti fotografiji. Zbrali so se na znamenitih konferencah, ki jih je sponzoriral Ernest Solvay, kemik in industrijski belgijski izvor, ki so postali znani v svetu znanosti.
Začeli so se odvijati od leta 1911 in združevanje največjih znanstvenikov trenutka, med njimi so bili praktično vsi, ki so prispevali k trenutnemu atomskemu modelu.
Najbolj znane od teh konferenc so potekale v Bruslju leta 1927 in tam je bila posneta ta zgodovinska fotografija:
 Slika 3. 1927 Udeleženci konference Solvay v Bruslju. Vir: Wikimedia Commons.
Slika 3. 1927 Udeleženci konference Solvay v Bruslju. Vir: Wikimedia Commons.  Slika 4. Udeleženci konference Solvay 1927.
Slika 4. Udeleženci konference Solvay 1927. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Donder Théophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max Born
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels bohr
- Owen Williams Richardson
Zanimivi članki
Schrödinger Atomski model.
Broglie Atomski model.
Chadwick Atomski model.
Heisenberg Atomski model.
Perrin atomski model.
Thomson Atomski model.
Dalton Atomski model.
Atomski model Dirac Jordan.
Atomski model Demokrita.
Atomski model Leucipo.
Atomski model Bohr.
Reference
- Alonso - Finn. Kvantni in statistični temelji. Addison Wesley.
- Bauer, w. 2011. Fizika za inženiring in znanosti. Zvezek 1. MC Graw Hill.
- Eisberg in Resnick. Kvantna fizika. Limusa - Wiley.
- Wikipedija. Atomska teorija. Okrevano od: je.Wikipedija.com
- Zapata f. Tiposični model atoma. Pridobljeno iz: Lifer.com

