Mioglobin

- 3711
- 232
- Mr. Shane Larkin
 Struktura mioglobina
Struktura mioglobina Kaj je mioglobin?
The Mioglobin Gre. Njegova temeljna funkcija je, da sestavlja rezervo za kisik in daje prednost znotrajceličnem prevozu kisika.
John Kendrew in Max Perutz sta leta 1962 prejela Nobelovo nagrado za kemijo za študije o krogličnih beljakovinah. Ti avtorji razjasnijo tridimenzionalno strukturo mioglobina in hemoglobina. Zgodovinsko je bil mioglobin eden prvih beljakovin, od katerih je bila določena tridimenzionalna struktura.
Globolarne beljakovine so kompaktne molekule s sferično obliko; So topni v citosolu ali v lipidnem delu celičnih membran. Odgovorni so za glavna biološka dejanja, v nasprotju z vlaknastimi beljakovinami, katerih glavne funkcije so strukturne.
Mioglobin daje sveže meso rdeče. To se zgodi, ko je mioglobin oksigeniran kot oksimioglobin in železo, ki ga sestavljajo v železovem železu: MB-FE2+O2.
Ko je meso izpostavljeno okolju, železov, nestabilno, oksidirano in postane železov in pod temi pogoji se barva spremeni v rjave tone za tvorbo metamioglobina (MB-FE3 + + O2 ●-----).
Običajno so ravni krvnega miglobina zelo majhne, so v vrstnem redu mikrogramov na liter (μg/L). Te ravni se povečajo, ko se uničenje mišic pojavi kot pri rabdomiolizi skeletnih mišic ali v primeru srčnega infarkta z uničenjem tkiva in pri nekaterih miopatijah.
Njegova prisotnost v urinu opazimo v določenih pogojih, v katerih je poškodba tkiva zelo pomembna. Njegova zgodnja diagnostična vrednost za srčni infark.
Vam lahko služi: celično jedroStruktura mioglobina
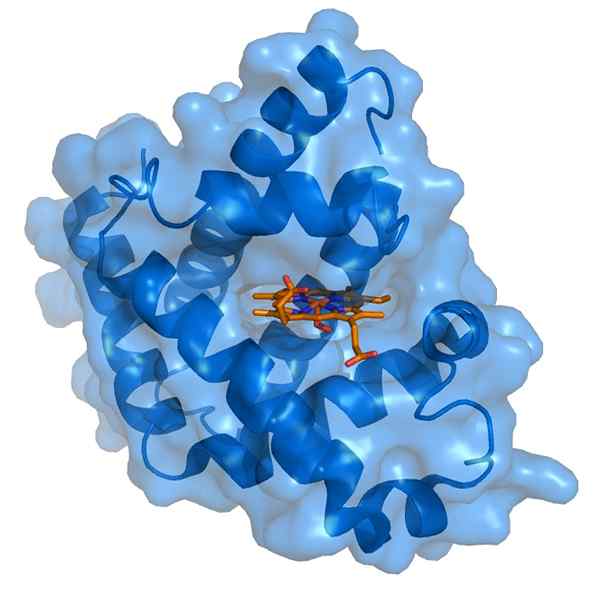 Mioglobin in njena hemo protetična skupina (vir: Thomas Schettttsser/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0) prek Wikimedia Commons)
Mioglobin in njena hemo protetična skupina (vir: Thomas Schettttsser/CC by-S (https: // creativeCommons.Org/licence/by-sa/3.0) prek Wikimedia Commons) Mioglobin ima molekulsko maso skoraj 18 kDa, vključno s hemo skupino. Sestavljen je iz štirih vijačnih segmentov, združenih z "nenadnimi zavoji". Ti mioglobinski propelerji so tesno pakirani in ohranjajo svojo strukturno celovitost, tudi ko je skupina hemo odstranjena.
Struktura krogličnih beljakovin in vseh celičnih beljakovin je hierarhična, zato je tudi struktura mioglobina. Prva raven je primarna struktura, ki jo tvori linearno zaporedje aminokislin, mioglobin.
Sekundarna struktura mioglobina je sestavljena v tvorbi alfa propelerja. Mioglobin vsebuje 8 alfa propelerjev, ki jih tvorijo ponavljajoči se polipeptidni deli, ki se vežejo s kratkimi segmenti upravljanja z aperiadom.
Terciarna struktura je sestavljena iz tridimenzionalne konformacije z biološko aktivnostjo. Najpomembnejše značilnosti te strukture so zložljive. Kvaternarna struktura se nanaša na sklop dveh ali več ločenih in združenih polipeptidnih verig z nekovalentnimi povezavami ali interakcijami.
Mioglobin ima zelo kompaktno strukturo, s hidrofobnimi odpadki, usmerjenimi v notranjost in hidrofilne ali polarne ostanke, usmerjene navzven. Notranji apolarni odpadki tvorijo levcin, valin, metoda in fenilalanin. Edini notranji polarni odpadki sta dva histidina, ki imata funkcije v aktivnem centru.
Hemo protetična skupina se nahaja v razcepju apolarnega notranjega dela polipypeptidne verige poliloglobina. Ta skupina vsebuje železo v obliki železovega železa, ki se veže na kisik, da tvori oksimioglobin.
Vam lahko služi: glut4: značilnosti, struktura, funkcijeFunkcija mioglobina
Funkcija mioglobina je združevanje kisika v hemo skupino njene strukture in tvori rezervo za kisik za mišično delovanje. Kolikor je kisik ujet v strukturo mioglobina v citoplazmi mišične celice, njen znotrajcelični tlak, določen s prostim kisikom, ostane nizek.
Nizek medcelični tlak kisika ohranja gradient za vhod v kisik do celice. To daje prednost prehodu kisika iz obtočnega hudournika v mišično celico. Ko mioglobin nasiči medcelični kisik, kar postopoma zmanjšuje gradient in tako zmanjša prenos.
Krivulja vezave kisika na mioglobin je hiperbolična. V začetnih delih krivulje majhne spremembe delnega tlaka kisika povzročajo velike spremembe v nasičenosti mioglobina s kisikom.
Potem, če delni tlak s kisikom poveča, se nasičenost še naprej povečuje, vendar je počasneje, to je veliko večje povečanje delnega kisikovega tlaka.
Obstaja spremenljivka, ki meri afiniteto krivulje, imenovano P50. Torej, če se P50 poveča, se reče, da ima mioglobin manj afinitete in če se P50 zmanjšuje.
Vam lahko služi: proeritroblast: značilnosti, morfologija, ureditev, obarvanjeKo preučimo krivulje vezave kisika z mioglobinom in hemoglobinom.
Vrste mišičnih vlaken in mioglobina
Skeletne mišice imajo v svoji sestavi različne vrste mišičnih vlaken, nekatere klice počasnega kontrakcije in druge hitrega krčenja. Vlakna s hitro kontrakcijo so strukturno in presnovno prilagojena hitro in budno in živahno in na anaerobni način.
Vlakna s počasnimi kontrakcijami so prilagojena za nizko hitrost, vendar daljše kontrakcije, značilne za vaje za aerobno odpornost. Ena od strukturnih razlik teh vlaken je koncentracija mioglobina, ki jim daje ime belih in rdečih vlaken.
Rdeča vlakna imajo visoko vsebnost mioglobina, kar jim daje rdečo barvo, ki jim omogoča tudi vzdrževanje velikih količin kisika, kar je nujno potrebno za njihovo funkcijo.
Normalne vrednosti
Običajne vrednosti krvi za moške so od 19 do 92 µg/L in pri ženskah od 12 do 76 µg/L, vendar obstajajo razlike v vrednostih v različnih laboratorijih.
Te vrednosti se povečajo, ko se uničenje mišic pojavi kot pri rabdomiolizi skeletnih mišic, v obsežnih opeklinah, električnih udarcih ali v obsežni mišični nekrozi zaradi arterijske okluzije, v miokardnem infarktu in v nekaterih miopatijah.
V teh pogojih se mioglobin pojavlja v urinu in mu daje značilno barvo.

